Kardiogener Schock
im Jahre 2020
Dr. med. Konstantin Schraepler, Bremen 09/2020
Schock
kardiogener Schock
primäre Herzerkrankung, die zu ineffektiven Herzzeitvolumen mit klinischer und biochemischer Manifestationen einer unzureichenden Gewebedurchblutung führt
erstmals 1912 von James B. Herrick beschrieben
.png)

Herrick JB (1912) JAMA 59:2015-2020
Kriterien des kardiogenen Schocks
anhand SHOCK-Trial (1999)
- systemische Hypotonie <90 mmHg (über >30 min.)
- oder: Notwendigkeit mittels Katecholaminen oder intraaortaler Ballongegenpulsation den systolischen Blutdruck auf >90 mmHg zu stabilisieren
- Zeichen einer systemischen Minderperfusion (ohne Besserung auf Volumengabe)
- Diurese <30 ml/h
- kalt-schweissige, zyanotische Haut/ Extremitäten
- zerebrale Minderperfusion mit Somnolenz u./o. Verwirrtheit
- Herzindex <2,2 l/min/m2
- Pulmonalkapillärer Verschlußdruck >15 mmHg
bisher keine allgemeingültigen definierten klinische Kriterien
 Vahdatpour C et al. (2019) J Am Heart Assoc 8:e011991
Vahdatpour C et al. (2019) J Am Heart Assoc 8:e011991
Jones TL et al. (2019) Open Heart 6:e000960
... warum ist die Einigung über die klinischen Kriterien so schwer?
Kriterien des kardiogenen Schocks
Schwierigkeit der Definition
kardiogener Schock kein Zustand sondern ein Kontinuum, das sich von Zuständen vor dem klinisch manifesten Schock bis zum refraktären Schock erstreckt und die die zeitlichen Erwägungen verschiedener Interventionen beeinflusst.
Vahdatpour C et al. (2019) J Am Heart Assoc 8:e011991Stadien
Stadien des kardiogenen Schocks
nach Baran DA et al. (2019) Catheter Cardiovasc Interv 94:29-37Stadien des kardiogenen Schocks
nach Baran DA et al. (2019) Catheter Cardiovasc Interv 94:29-37Stadien des kardiogenen Schocks
nach Baran DA et al. (2019) Catheter Cardiovasc Interv 94:29-37Stadien des kardiogenen Schocks
nach Baran DA et al. (2019) Catheter Cardiovasc Interv 94:29-37Stadien des kardiogenen Schocks
nach Baran DA et al. (2019) Catheter Cardiovasc Interv 94:29-37Ursachen
kardiogener Schock
Ursache akuter Myokardinfarkt
CardShock Study: [n=219, Ø 67 Jahre]
81% zugrunde liegendes Akutes Koronarsyndrom, davon 68% STEMI, 8% mechanische Komplikationen
- myokardiales Pumpversagen
- großer Myokardinfarkt
- kleinerer Myokardinfarkt bei vorbestehender linksventrikulärer Dysfunktion
- Re-Myokardinfarkt
- Infarktausdehnung
- mechanische Infarktkomplikationen
- akute Mitralinsuffizienz aufgrund eines Papillarmuskelabrisses
- Ventrikelseptumdefekt
- Ruptur der freien Wand
- Perikardtamponade
- Rechtsherzinfarkt
Hochmann JS et al. (1999) N Engl J Med 341:625-634
Reynolds HR, Hochman JS (2008) Circulation 117:686-697
kardiogener Schock
Ursachen außer dem Myokardinfarkt
- Endstadium Kardiomyopathie
- Myokarditis
- Myokardkontusion
- septische Kardiomyopathie
- Obstruktion des linksventrikulären Ausflußtraktes
- Aortenklappenstenose
- hypertroph obstruktive Kardiomyopathie
- Behinderung der linksventrikulären Füllung
- Mitralstenose
- Myxom des linken Atriums
- akute Mitralinsuffizienz aufgrund Sehnenfädenabriß
- akute Aortenklappeninsuffizienz
- Schock nach Herz-Lungenmaschine
Hochmann JS et al. (1999) N Engl J Med 341:625-634
Reynolds HR, Hochman JS (2008) Circulation 117:686-697
Kardiogener Schock nach Myokardinfarkt
Häufigkeitsverteilung der Ursachen [n=1422]
| myokardiale Pumpfunktionseinschränkung | |
| linksventrikuläres Pumpversagen | 78,5% |
| rechtsventrikuläres Pumpversagen | 2,8% |
| mechanische Infarktkomplikationen | |
| schwerwiegende Mitralinsuffizienz | 6,9% |
| Ventrikelseptumruptur | 3,9% |
| Tamponade der freien Wand | 1,4% |
| andere Ursachen | 6,7% |
Mortalität
Kardiogener Schock
Mortalitätsentwicklung bis 2004
 Babaev A (2005) JAMA 294:448-454
Babaev A (2005) JAMA 294:448-454
Kardiogener Schock
Mortalitätsentwicklung der letzten 20 Jahre [Beispiel Schweiz, n=52805]
 Hunziker L et al. (2019) Circ Cardiovasc Interv 12:e007293
Hunziker L et al. (2019) Circ Cardiovasc Interv 12:e007293
Kardiogener Schock
Mortalitätsentwicklung Bremen [2006-2016, n=981]
 Backhaus T et al. (2018) Clin Res Cardiol 107:371-379
Backhaus T et al. (2018) Clin Res Cardiol 107:371-379
Kardiogener Schock
Prediktoren des kardiogenen Schocks
- hohes Alter
- verminderte linksventrikuläre Ejektionsfraktion bei Aufnahme
- Diabetiker
- großer Myokardinfarkt
- Myokardinfarkte in der Vorgeschichte
Fakten
kardiogener Schock
Fakten
- ca. 7% der Patienten mit akutem Myokardinfarkt entwickeln einen kardiogenen Schock
- Einsetzen des kardiogenen Schocks durchschnittlich 6,2 Stunden nach Infarktbeginn
- 11% der Patienten weisen den kardiogenem Schock beim Eintreffen im Krankenhaus auf
89% entwickeln ihn während des stationären Aufenthaltes - ⅔ der Patienten weisen ST-Hebungs-Infarkt auf
⅓ besitzen nur diffuse ST-Streckensenkungen mit oder ohne Schenkelblock
Letalität beider Gruppen ist gleich hoch - 28% der Patienten im kardiogenen Schock besitzen keine Zeichen einer Lungenstauung
Kardiogener Schock (nach Myokardinfarkt)
Krankenhausmortalität der SHOCK Trial Registry
bei Auftreten eines kritischen Anteils von
| klassischer kardiogener Schock | 66% | [n=943] |
| nicht-hypotensiver kardiogener Schock | 43% | [n=49] |
| arterielle Hypotension ohne Hypoperfusion | 26% | [n=76] |
Pathophysiologie
Kardiogener Schock
Pathophysiologie des kardiogenen Schocks
bei Auftreten eines kritischen Anteils von
- nichtfunktionalem, linksventrikulärem Myokard [>35%]
kommt es zum kardialen Pumpversagen
Alonso DR et al. (1973) Circulation 48:588-596Kardiogener Schock
reversible kontraktile Dysfunktion des Myokards
Areale nicht-funktionalen aber vitalen Myokards bedingen nach Myokardinfarkt ebenfalls Entwicklung des kardiogenen Schocks
- myokardiales Stunning
- Hibernation
Diamond GA et al. (1978) AM Heart J 95:204-209
Kardiogener Schock
Pathophysiologie des kardiogenen Schocks
kardiale Dysfunktion im kardiogenen Schock verstärkt selber die myokardiale Ischämie aufgrund der Reduktion des myokardialen Perfusionsdruck durch Verminderung des arteriellen Blutdrucks
![Pfeil]() circulus vitiosus (Abwärtsspirale)
circulus vitiosus (Abwärtsspirale)
Kardiogener Schock
Pathophysiologie des kardiogenen Schocks
 modifiziert nach Hochmann JS (2003) Circulation 107:2998-3002
modifiziert nach Hochmann JS (2003) Circulation 107:2998-3002
... ist das alles?

kardiogener Schock
noch mehr Fakten (Resulte des Shock Trials)
- große Bandbreite der LV-EF (~30%) und LV-Diameter
- SVR ~1350-1400 dyn x s/cm5 mit starker Variation der Bandbreite und unterschiedlich ausgeprägtem Ansprechen auf Vasopressoren
- „klassische Ansicht“ der akuten Reduktion des Herzzeitvolumen mit kompensatorischer Vasokonstriktion nicht zu bestätigen
- meisten Überlebenden eines kardiogenen Schocks besitzen nach Ablauf eines Jahres eine Herzinsuffizienz NYHA Stadium I
- jeder 5. Patient mit klinisch nachweisbarer systemisch inflammatorischer Entzündungsreaktion (SIRS) Menon V et al. (2000) Am J Med. 108:374-380
Picard et al. (2003) Circulation 107:279-284
Kardiogener Schock
Pathophysiologie des kardiogenen Schocks

 modifiziert nach Hochmann JS (2003) Circulation 107:2998-3002
modifiziert nach Hochmann JS (2003) Circulation 107:2998-3002
Expanding the Paradigm
kardiogener Schock und SIRS
- Entwicklung eines SIRS besitzt Schlüsselrolle im Krankheitsprozeß
- signifikant vermehrte Freisetzung von IL-6 bei letalem Verlauf
- Versterbende besitzen signifikant höheren APACHE-II als Ausdruck des manifesten MODS
Expanding the Paradigm
Hierachie der Prognoseparameter
- SAPS-II- und der APACHE-II-Score aufgrund der Einbeziehung eines Multiorganversagens beste prognostische Aussagekraft
- träge, nicht für Therapiesteuerung geeignet
- Biomarker der Entzündung und Gewebeschädigung (damage associated molecular patterns = DAMP) wie IL-6, RAGE und sRAGE
- RAGE-Expression auf Monozyten und sRAGE-Plasmaspiegel mit stärkster Prognosekorrelation auf
- hämodynamische Kenndaten wie Cardiac Power Index, rechtsventrikulärer Cardiac Power Index, CI etc.
- Biomarker der Herzinsuffizienz wie BNP, pro-BNP
Kardiogener Schock
Pathophysiologie des kardiogenen Schocks
Die Unterbrechung dieser Schockspirale und die Wiederherstellung der kardiovaskulären Homöostase ist von zentraler Bedeutung für die Behandlung des kardiogenen Schocks
Jones TL et al. (2019) Open Heart 6:e000960...frühzeitige Identifikation und Behandlung des Hochrisiko-Patienten kann möglicherweise jeden zweiten kardiogenen Schock verhindern
Diagnostik
Monitoring
Diagnostik
Diagnose
... ist bei Erstkontakt auf der Basis von klinischen Symptomen und nicht-invasiven hämodynamischen Messungen zu stellen
nicht-invasive Diagnostik I
was ist zu tun?
- Anamnese
- Klinische Untersuchung
- Killip-Klassifikation bei Myokardinfarkt
Killip-Klassifikation
| Klasse 1 | kein Herzinsuffizienz | Letalität 6% | |
| keine klinischen Zeichen einer kardialen Dekompensation | |||
| Klasse 2 | mäßige Herzinsuffizienz | Letalität 18% | |
| Rasselgeräusche in der unteren Hälfte der Lungenfelder, 3. Herzton, pulmonalvenöse Stauung |
|||
| Klasse 3 | schwere Herzinsuffizienz | Letalität 35% | |
| Lungenödem mit Rasselgeräuschen in allen Lungenfeldern | |||
| Klasse 4 | kardiogener Schock | Letalität 70% | |
| Kriterien des kardiogenen Schock | |||
nicht-invasive Diagnostik I
was ist zu tun?
- Anamnese
- Klinische Untersuchung
- Killip-Klassifikation bei Myokardinfarkt
- 12-Kanal-EKG
- erweiterten Ableitungen (V7 bis V9)
- rechtsventrikuläre Ableitungen (rV3 bis rV6) → Rechtsherzinfarkt?
- <10 Minuten nach medizinischen Erstkontakt und <30-60 Minuten nach perkutaner Koronar-Intervention bzw. nach operativer Koronar-Intervention sowie 90-120 Minuten nach Beginn systemischer Lysetherapie wiederholen
- myokardialen Enzyme und Proteine wie Troponine (hs-cTnT, hs-cTnI) und CK/ CK-MB
- arterielle/ kapilläre Blutgasanalysen !!
- Laktat
- Nierenretentionswerte (Harnstoff, Creatinin)
- sowie Blutbild, Elektrolyte (Na+, K+), Gerinnungsfaktoren, Leberwerte (GOT, GPT, Bilirubin), C-reaktives Protein, Blutzucker
nicht-invasive Diagnostik II
was ist zu tun?
- Rö-Thorax
- Echokardiographie
- linksventrikulären Funktion
- Hämodynamik
- regionale Wandbewegungsstörungen
- Infarktkomplikationen [z.B. akute Mitralinsuffizienz]
- Ventrikelseptumdefekt
- Perikardtamponade
- Rechtsherzbelastung
- Lungensonographie
- Nachweis eines interstitiellen bzw. alveolären Syndroms
- zum Ausschluss von Differentialdiagnosen
Palazzuoli A et al. (2018) Clin Res Cardiol 107:586-596
Platz E et al. (2019) Eur J Heart Fail 21:844-851
Soldati G. (2013) In: Sarti A., Lorini F. (eds) Springer, Milano 2012:389-395
Volpicelli G et al. (2008) Am J Emerg Med. 2008;26(5):585-591
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Winkler MH et al. (2018) Crit Care Med 46:e707-e714
Therapie
Kardiogener Schock
spezifische Leitlinien
- European Society of Cardiology (ESC) 2016
- ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:
- Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF)
- Cardiogenic Shock due to Myocardial Infarction: Diagnosis, Monitoring and Treatment. A German-Austrian S3-guideline
- American College of Cardiology Foundation/ American Heart Association (ACCF/ ACC)
- 2009 Focused Update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults
- Organ der Deutschen Interdisziplinären Vereinigung für Intensivmedizin und Notfallmedizin (DIVI)
- Empfehlungen zur Diagnostik und Therapie der Schockformen der interdisziplinären Arbeitsgemeinschaft Schock der DIVI
Ponikowski P et al. (2016) Eur Heart J 37:2129-2200
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Yancy CW et al. (2013) JACC 62:e147-e239
- supplementive Sauerstoffgabe bei Myokardinfarkt kritisch zu überdenken
- Ventilationsstörung bei kardiogenem Schock nicht hypoxämisch bedingt
- nicht durch Sauerstoffgabe zu beseitigen sondern durch positiven Atemwegsdruck
Kardiogener Schock
Besonderheit des kardialen Lungenödems
- Zunahme des Sauerstoffverbrauchs der Atemmuskulatur von <5% im Normalfall auf >25% des Gesamtsauerstoffverbrauchs
- erhöhter Sauerstoffbedarf steht aufgrund eines verminderten HZV eine verminderte Sauerstoffzufuhr gegenüber
- aufgrund des im Verlauf hinzutretenden alveolären Lungenödems kommt es zu einer verminderte Sauerstoffsättigung
- O2-Gabe führt bei SaO2 >90% nicht zur Verbesserung des O2-Transportes und der Mortalitätssenkung
- O2-Gabe (8 l/min.) kann bei STEMI ohne Hypoxämie (SaO2 ≥94%) frühe Myokardverletzung und Infarktausdehnung erhöhen aufgrund
- (sekundärer) hämodynamischer Effekte
- Reduktion des Herzzeit- und Schlagvolumens
- Erhöhung des systemischen Widerstände (Koronargefäße!)
- Erhöhung des MAP
- der Entstehung freier Sauerstoffradikale mit Gefahr von Reperfusionsschäden
- (sekundärer) hämodynamischer Effekte
- negative Effekte stärker bei Patienten mit Myokardinfarkt <Killip III
Park JF et al.(2010) Heart 96:533-538
Russk HI et al. (1950) JAMA 144:373-375
Stub D et al. (2015) Circulation 131:2143-2150
Wijesinghe M et al. (2009) Heart 95:198-202
Therapiehilfen in der Erstversorgung
was für Möglichkeiten haben wir?
Empfehlungen zur Diagnostik und Therapie der Schockformen der IAG Schock der Deutschen Interdisziplinären Vereinigung für Intensivmedizin und Notfallmedizin
- peripher venöse Zugänge(!)
- bis ZVK-Anlage
- Verweilkanülen [min. 1,2 mm!!]
- in Zugang zusätzlich bei liegendem ZVK
- zentraler Venenkatheter
- obligat!
- großzügig Lumina wählen
- Zugangsweg abhängig vom Blutungsrisiko
- arterielle Druckmessung
- beat to beat-Monitoring
- repititive Blutgasanalysen
- endotrachealer Tubus
nicht-invasives Monitoring
was für Möglichkeiten haben wir?
- Klinik
- nichtinvasive Blutdruckmessung
- Pulsoxymetrie
- Körpertemperatur
- Atemfrequenz
- EKG-Monitoring
- Diurese
invasives Monitoring
was für Möglichkeiten haben wir?
- arterielle Druckmessung
- arterielle Blutgasanalyse
- zentraler Venenkatheter
- zentralvenöse Sauerstoffsättigung
- veno-arterielle pCO2-Differenz [pCO2-Gap]
- invasives hämodynamisches Monitoring
- Pulmonalarterienkatheter
- gemischtvenöse Sauerstoffsättigung
- transpulmonale Indikatordilutionsverfahren
- PiCCO®
- Pulskonturanalyse
- nicht anwendbar bei intraaortaler Gegenpulsation, eingeschränkt bei Vorhofflimmern und Klappenvitien
- PiCCO®
- PulseCO®
- FloTrac®
![Monitoring-Leitsatz]()
- Pulmonalarterienkatheter
Rechtsherzkatheter
Stand der Empfehlungen
- keine routinemäßige Anwendung
- Einsatz empfohlen bei instabilen Patienten
- die nicht in der erwarteten Weise auf die traditionelle Behandlung ansprechen
- die eine Kombination einer Lungenstauung und einer Hypoperfusion besitzen
- zur Optimierung intravaskulären Füllungsdrücken und differenziertem Einsatz vasoaktiver und inotroper Medikamente
- gemäß den Empfehlungen bzw. Leitlinien der DIVI, ESC, DGK, ACC
- Kenntnis des HZV zwingend erforderlich nach den Empfehlungen der DIVI
 Adams HA et al. (2014) Empfehlungen IAG Schock der DIVI
Adams HA et al. (2014) Empfehlungen IAG Schock der DIVI
Ibánez B et al. (2018) Eur Heart J 39:119-177
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
transpulmonale Indikatordilutionsverfahren
Stand der Empfehlungen
- Daten nur für die schwere Herzinsuffizienz vorliegend
- bisher 1 Studie [n=29] (!)
- keine Validierung bislang im kardiogenen Schock
- gleiche Zielkorridore wie für den Rechtsherzkatheter?
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Zukünftig keine weitere Intervention zu erwarten, die alleine für sich genommen zur deutlichen Senkung der Mortalität führt
Versorgung in allen Teilbereichen zu optimieren, um als Bündel die Prognose zu verbessern


- Diagnose anhand einfacher klinischer Kriterien zu stellen
- hierfür invasive Diagnostik (Herzzeitvolumens, Vorlast) nicht erforderlich!
- Diagnose des Infarkt-bedingten kardiogenen Schocks zum frühestmöglichen Zeitpunkt stellen
- möglichst in der Prähospitalphase
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock

Revaskularisation
Therapie der Wahl bei Myokardinfarkt
- perkutane Angioplastie [PCI]
- frühestmögliche Wiedereröffnung des verschlossenen Infarktgefäßes mittels DES-PCI, (wichtigste, oft einzig lebensrettende Maßnahme):
- umgehender Transport in Herzkatheterlabor mit Kompetenz in Akut-Koronarinterventionen
- Angioplastie (Drug eluting Stent) nur des Infarktgefäßes („Culprit-Lesion“)
- 10 min. Verzögerung 3,3 (ohne kardiogenem Schock 1,3) zusätzliche Todesfälle pro 100 Patienten
- frühestmögliche Wiedereröffnung des verschlossenen Infarktgefäßes mittels DES-PCI, (wichtigste, oft einzig lebensrettende Maßnahme):
- bei STEMI falls Katheterlabor nicht zur Verfügung: Thrombolysetherapie
- aortokoronare Bypassoperation [CABG]
bei kardiogenem Schock erhalten nur 60% Herzkatheter, wovon 50% revaskularisiert werden
Goldberg RJ et al. (2016) Circ Cardiovasc Qual Outcomes 9:117-125.Hochman JS et al. (1999) NEJM 341:625-634
Hochman JS et al. (2006) JAMA 295:2511-2515
Jones TL et al. (2019) Open Heart 6:e000960

Revaskularisation
Zeitkorridore bei Myokardinfarkt
| First Medical Contact (FMC) | bis Fibrinolyse | <10 min. | |
| bis PCI | <90 min. |
Der Begriff Door to balloon wurde aus den Leitlinien gestrichen. Es besteht eine lineare Beziehung zwischen Kontaktzeit und der Mortalität.
Ibanez B et al.(2018) Eur Heart J 39:119-177Scholz KH et al.(2018) Eur Heart J 39:1065-1074


physiologische Überlegungen
Sauerstoffbedarf des Herzmuskels
Verteilung des Sauerstoffbedarfs
| myokardialer Basisbedarf | 20% |
| elektrische Aktivität | 1% |
| Volumenarbeit | 15% |
| Druckarbeit | 64% |

Sauerstoffbedarf des Herzmuskels
Effekt auf myokardialen O2-Verbrauch bei 50% Anstieg der
| Wandspannung | 25% |
| Kontraktilität | 45% |
| Druckarbeit | 50% |
| Herzfrequenz | 50% |
| Volumenarbeit | 4% |


Physiologische Überlegungen
Kernaussagen
- Druckarbeit besitzt dominierenden Beitrag auf den myokardialen Sauerstoffverbrauch (MVO2)
- ausgeprägtester negativer Effekt auf den myokardialen Sauerstoffverbrauch durch Anstieg von Druckarbeit und Herzfrequenz
- bei gleichem HZV gilt:
Kombination hohe Herzfrequenz mit kleinem Schlagvolumina führt zu höherem Sauerstoffverbrauch als geringe Herzfrequenz mit höherem Schlagvolumen
Ökonomisierung Herzarbeit und Sauerstoffverbrauch
Behandlung von Schmerzen/ Streß
- Verminderung der überschießenden sympatischen Aktivität
- Senkung der Vor- und Nachlast
Ökonomisierung Herzarbeit und Sauerstoffverbrauch
Behandlung von Schmerzen/ Streß
- Morphin
- analgetisch, euphorisierende Komponente
- fraktioniert 0,05-01, mg/kg KG i.v. (z.B. Boli à 2,5 mg)
- durch zentrale Dämpfung und moderate Histamin-Freisetzung: Senkung der Vor- und Nachlast
- Midazolam
- sedierend, anxiolytisch
- fraktioniert 0,025-0,05 mg/kg KG i.v. (z.B. Boli à 1-2 mg)
Vorlastoptimierung
Frank-Starling-Mechanismus


wesentlicher physiologischer Mechanismus zur Aufrechterhaltung der Strömungskontinuität im kleinen und großen Kreislauf
Otto Frank (1865-1944)
Ernest Henry Starling1866-1927)
Vorlastoptimierung
Frank-Starling-Mechanismus
- Behandlung eines Volumendefizits und
- Vorlastoptimierung (fluid-responsivness?)
- Ansprechen der kardialen Funktion (= preload-sensitivity) auf eine Vorlasterhöhung (= fluid responsiveness)
Vorlastoptimierung
Steuerung mittels invasivem Monitoring
- ZVD und PCWP zeigen bei beatmeten Patienten unzureichend, ob die Volumengabe zu einer Verbesserung der kardialen Funktion führt
- nur wenig Daten von Pulskonturanalyseverfahren, die die Eignung zur Volumensteuerung im kardiogenen Schock belegen
- nach interventionsfreier Periode von >1 Std ist Rekalibration notwendig
- nach Interventionen (Volumengabe, Veränderung Katecholamindosis) früher
- einfachste Indikator eines Volumenmangels ist der passive Beinhebeversuch
- immer(!) Kontrolle, ob gemessene Werte echokardiographisch durch die Kammerfüllung und Pumpfunktion zu bestätigen sind
MZhang YB et al. (2019) World J Clin Cases 7:1291-1301
Ökonomisierung Herzarbeit und Sauerstoffverbrauch
medikamentöse Nachlastsenkung
- Voraussetzung: Ausgleich eines Volumendefizits
- je nach Ursache des kardiogenen Schocks Steigerung des Schlagvolumens und somit des Herzzeitvolumens sowie der Koronar- und Organperfusion
aber auch:
mögliche Verminderung der Koronar-/ Organperfusion!! - Kombination mit inotropen Pharmaka möglich
medikamentöse Nachlastsenkung
Substanzen mit fehlendem klinischem Nutzennachweis
- Aliskiren [ASTRONAUT] = direkter Renin-Inhibitor
- Nesiritide [ASCEND-HF] = rekombinantes natriuretisches Peptid
- Rolofyllin [PROTECT, REACH UP] = Adenosin A1-Rezeptorantagonist
- Tezosentan [VERITAS] = Endothelin Antagonist
- Tilarginin [TRIUMPH] = nicht-selektiven Stickoxidsynthasehemmer
- Tolvaptan [EVEREST Outcome] = Vasopressin (V2) Rezeptorantagonist
- Serelaxin [RELAX-AHF-2] = humanes rekombinantes Relaxin-2
- Ularitide [TRUE-HF] = synthetisches Urodilatin (natriuretisches Peptid der Nieren)
medikamentöse Nachlastsenkung
noch in der Erprobung befindliche Substanzen
- Cinaciguat (BAY 58-2667) = Guanylatcyclase-Aktivatoren
- Istaroxim [HORIZON-HF] = Natrium-/Kalium-ATPase-Inhibitor und Calcium ATPase Isoform 2a-Aktivator (SERCA 2a)
- Omecamtiv Mecarbil [ATOMIC-AHF] = Myosin-Aktivator
- TRV027 [BLAST-AHF] = selektiver AT1-Rezeptoragonist
medikamtöse Nachlastsenkung
Nitroprussidnatrium bei akuter Herzinsuffizienz
- Patienten mit akut auf chronisches Herzversagen
- (CI <2 l/min./m2, PCWP ≥18 mmHg, MAP >60 mmHg)
- Kollektiv: NPS n = 78; Kontrollgruppe n = 97
- medianer Follow up 25,7 Monate
- Mortalität: NPS = 29%, Kontrollgruppe 44% (p = 0,005)
- Mortalität oder HTx: NPS = 63%, Kontrollgruppe 79% (p = 0,016)
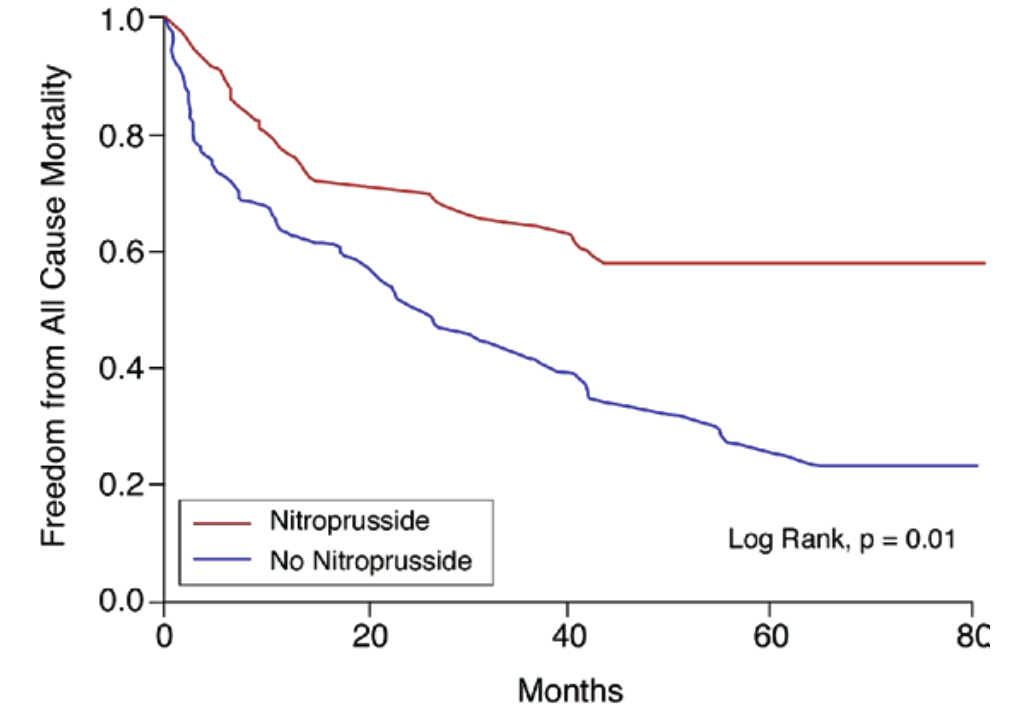 Mullens W et al. (2008) J Am Coll Cardiol 52:200-207
Mullens W et al. (2008) J Am Coll Cardiol 52:200-207
medikamtöse Nachlastsenkung
Nitroprussidnatrium
- venöse = arterielle Vasodilatation (Vorlastsenkung = Nachlastsenkung)
- gut steuerbar (HWZ ~ 1-2 min.)
- Beginn mit 0,3 µg/kg KG/min.
- Steigerung der Dosis alle 2 min. bis erwünschter Effekt erreicht
- beschriebene Langzeit-Mortalitätssenkung
cave Cyanidintoxikation:
Kombination mit Natriumthiosulfat im Verhältnis 1 : 10 bei Gabe von >2 µg/kgKG/min.
... ein Fallbeispiel
Patient, 59j
Fallbeispiel, Patient, 59j
Anamnese
- koronare Drei-Gefäßerkrankung
- dilatative Verlaufsform [ED 3 Jahre zuvor]
- Non-ST-Elevations-Myokardinfarkt [1 Monat zuvor]
- nicht-anhaltende ventrikuläre Tachykardie
- rhythmogene Synkopen [2 Jahre zuvor]
- AICD-Implantation [2 Jahre zuvor]
- rezidivierende monomorphe ventrikuläre Tachykardien mit Schockabgabe [2 Monate zuvor]
- hypertrophe nicht-obstruktive Kardiomyopathie [ED 3 Jahre zuvor]
- dynamische Mitralklappeninsuffizienz
- permanentes Vorhofflimmern
Fallbeispiel, Patient, 59j
Anamnese
Einweisung in das Krankenhaus aufgrund des Verdachtes einer Progredienz der bekannten koronaren Herzkrankheit. Der Patient beklagte seit 11 Tagen erstmals wieder unter geringer Belastung auftretende retrosternale Schmerzen [CCS III].
dann:
Fallbeispiel, Patient, 59j
weiterer stationärer Verlauf
Auftreten einer anhaltenden langsamen ventrikulären Tachykardien, die nicht durch Entladung des AICD terminiert wurde [Detektionsfrequenz für ventrikuläre Tachykardien 142/min.]
begleitend progrediente Dyspnoe, Kaltschweissigkeit, Akrozyanose
Konversion in einen langsamen Rhythmus nach Amiodaron i.v.
bei unveränderter Klinik Verlegung auf die Intensivstation
Fallbeispiel, Patient, 59j
stationärer Verlauf
| Leukozyten | 10,4 /nl |
| Hb | 15,8 g/dl |
| CK | 127 mg/dl |
| cTnT | 0,05 µg/l |
| pH | 7,41 |
| PCO2 | 36,0 mmHg |
| PaO2 | 55,3 mmHg |
| SaO2 | 98,4 % |
| HCO3 | 22,0 mmol/l |
| BE | -1,1 mmol/l |
| Lactat | 1,88 mmol/l |
Fallbeispiel, Patient, 59j
stationärer Verlauf
| Blutdruck | 145/70 mmHg |
| MAP | 95 mmHg |
| Herzfrequenz | 46 /min. |
Echokardiographie: Pumpversagen [EF ~35%]
normalgroßer linker Ventrikel mit eingeschränkter Kontraktilität [EF ~35%], Akinesie der Apex, der inferolateralen, der apikoseptalen und der anteroapikalen Wand. MV-Insuffizienz II-III°.
Herzkatheter: Darstellung der LCA
Linke Koronararterie:
schwerste verkalkende Sklerose
60%-ige Stenose des Ramus diagonalis II
95%-ige Stenose des medialen LAD
60%-ige Stenose der proximalen LCx

Herzkatheter: Darstellung der RCA
rechte Koronararterie:
90%-ige Stenose der proximalen RCA
90%-ige Stenose des RIVP
60%-ige Stenose des R. posterolateralis

Herzkatheter: Laevokardiogram
Laevokardiogramm:
regional stark eingeschränkte LV-Funktion, Akinesie anterolateral, Akinesie inferoapikal, Ejektionsfraktion = 35%
Fallbeispiel, Patient, 59j
arterielle Blutgasanalyse
| pH | 7,41 |
| PCO2 | 36,0 mmHg |
| PaO2 | 55,3 mmHg |
| SaO2 | 98,4 % |
| HCO3 | 22,0 mmol/l |
| BE | -1,1 mmol/l |
| Laktat | 1,88 mmol/l |
| pH | 7,46 |
| PCO2 | 36,0 mmHg |
| PaO2 | 121 mmHg |
| SaO2 | 97,0 % |
| HCO3 | 26,0 mmol/l |
| BE | 2,9 mmol/l |
| Lactat | 0,8 mmol/l |
Fallbeispiel, Patient, 59j
Blutgasanalysen
| pH | 7,46 |
| PCO2 | 36,0 mmHg |
| PaO2 | 121 mmHg |
| SaO2 | 97,0 % |
| HCO3 | 26,0 mmol/l |
| BE | 2,9 mmol/l |
| Lactat | 0,8 mmol/l |
| PCO2 | 52,3 mmHg |
| SaO2 | 43,3 % |


 Cuschieri J et al. (2005) Intensive Care Med 31:818-822
Cuschieri J et al. (2005) Intensive Care Med 31:818-822
Dres M et al. (2012) J Clin Monit Comput 26:367-374
Fallbeispiel, Patient, 59j
Hämodynamik
| Blutdruck | 143/82 | mmHg |
| MAP | 99 | mmHg |
| Herzfrequenz | 54 | /min. |
| ZVD | 12 | mmHg |
| Herzzeitvolumen | 2,03 | l/min. |
| Herzindex | 1,07 | l/min./m2 |
| Schlagvolumen | 38 | ml |
| Schlagvolumenindex | 20 | ml/m2 |
| SVR | 3427 | dyn·s/cm5 |
| SVRI | 6511 | dyn·s·m²/cm5 |
Was sagt uns das und wie schwer ist der Patient erkrankt?
Kardiogener Schock
hämodynamische Prognoseparameter
 Fincke R et al. (2004) J Am Coll Cardiol 44:340-348
Fincke R et al. (2004) J Am Coll Cardiol 44:340-348
Kardiogener Schock
hämodynamische Prognoseparameter
Cpoin Watt = HZV in l/min.x MAPin mmHg / 451
Normwert >0,6 W
der einzige validierte Prognose-Parameter für den infarktbedingten kardiogenen Schock
Cotter G et al. (2003) Eur J Heart Fail 5:443-51Fincke R et al. (2004) J Am Coll Cardiol 44:340-348
Fallbeispiel, Patient, 59j
Hämodynamik
| Blutdruck | 143/82 | mmHg |
| MAP | 99 | mmHg |
| Herzfrequenz | 54 | /min. |
| ZVD | 12 | mmHg |
| Herzzeitvolumen | 2,03 | l/min. |
| Herzindex | 1,07 | l/min./m2 |
| Schlagvolumen | 38 | ml |
| Schlagvolumenindex | 20 | ml/m2 |
| SVR | 3427 | dyn·s/cm5 |
| SVRI | 6511 | dyn·s·m²/cm5 |
| Cpo | 0,45 | Watt |

Kardiogener Schock
hämodynamische Prognoseparameter
 Fincke R et al. (2004) J Am Coll Cardiol 44:340-348
Fincke R et al. (2004) J Am Coll Cardiol 44:340-348
Fallbeispiel, Patient, 59j
Hämodynamik
| Blutdruck | 143/82 | 116/71 | mmHg |
| MAP | 99 | 71 | mmHg |
| Herzfrequenz | 54 | 44 | /min. |
| ZVD | 12 | 21 | mmHg |
| Herzzeitvolumen | 2,03 | 4,43 | l/min. |
| Herzindex | 1,07 | 2,33 | l/min./m2 |
| Schlagvolumen | 38 | 101 | ml |
| Schlagvolumenindex | 20 | 53 | ml/m2 |
| SVR | 3427 | 1155 | dyn·s/cm5 |
| SVRI | 6511 | 2195 | dyn·s·m²/cm5 |
| Cpo | 0,45 | 0,70 | Watt |

= hämodynamische Stabilisierung
Hämodynamische Stabilisierung
Zielkriterien
| Mittlerer Blutdruck | MAP | (55 bei erhaltener Nierenfunktion) 65 bis 75 mmHg |
| Herzindex* | CI | ≥2,0 l/min/m2 |
| Optimierung O2-Versorgung | - Hb 8,0 bis 10,0 g/l - SvO2 >70% - Normalisierung Laktat (<2,2 mEq/l) |
|
| Beseitigung Organdysfunktion | - Diurese >0,5-0,7 ml/kg/h - Beseitigung der Enzephalopathie |
* Schlagvolumen-Index als Zielkriterium (SVI ≥35 ml/m2) bietet ggü. dem Herzindex den Vorteil der Einschätzung sowohl der Herzfunktion unabhängig von der Herzfrequenz als auch der Volume-Responsivness in Anlehnung an den Frank-Starling-Mechanismus
Osawa EA et al. (2016) Crit Care Med 44:724-733Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Einsatz von Inotropika/ vasoaktiven Substanzen
Medikamentengruppen:
- Katecholamine
- Vasopressoren
- Inotropika
- Phosphodiesterase-Inhibitoren
- Calcium-Sensitizer
belastbare Daten fehlen, Studien mit inaktiven Behandlungsarmen schwierig zu konzipieren und durchzuführen
Guarracino F et al. (2020) Eur Heart J Suppl 22(Suppl D):D3-D11Ponikowski P et al. (2016) Eur Heart J 37:2129-2200
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Katecholamine
Allgemeines
- pharmakologisches Rückgrad der inotropen Therapie
- verfügbar: positiv inotrope und vasokonstriktorische Substanzen
- können kardiale Funktion kurzeitig verbessern
- einfaches handling
- vorhersagbare Pharmakodynamik, vorteilhaftes pharmakokinetisches Profil
- schnelle Titration bis erwünschte Wirkungen
- kurze Halbwertszeit bei Auftreten unerwünschter Effekte
 Bistola V et al. (2019) Card Fail Rev 5:133-139
Bistola V et al. (2019) Card Fail Rev 5:133-139
Polyzogopoulou E et al. (2020) Curr Opin Crit Care 26:403-410
Katecholamine
Differentialtherapie
- i.v.-Inotropika wenn RRsyst <85 mmHg u./o. Hypoperfusion
- trotz Optimierung von Vor-, Nachlast und Herzfrequenz bzw. mittlerer arterieller Druck <65 mmHg, Einzelfallentscheidung unter Beachtung der aktuellen Hämodynamik
- Dobutamin (vorrangig inotrop) erste Wahl bei geringer Hypotonie (RRsyst 70 - 85 mmHg)
- Dosierung: 2 - 20(40) μg/kg Kg/min. (Tagestherapiekosten* ca. 20(40) €)
- Noradrenalin (vorrangig vasokonstriktorisch) bei therapierefraktärer Hypotonie
- Dosierung: 0,01 - 0,5(1,0) μg/kg Kg/min.(Tagestherapiekosten* ca. 32(64) €)
- ggü. Adrenalin klinische Vorteile
- Adrenalin als ultima ratio
- Dosierung: 0,01 - 0,5(1,0) μg/kg Kg/min. (Tagestherapiekosten* ca. 34(68) €)
- Dosierung so gering, Applikationszeit so kurz wie möglich
*Maximaldosierung, Körpergewicht 70 kg
IABP-SHOCK II-Trial (2012):
74 % Noradrenalin, 53% Dobutamin, 26% Adrenalin, 4% Dopamin
Rex S in: Marx G, Muhl E, ZacharowskiK, Zeuzem S, Springer 2014 471-477
Ponikowski P et al. (2016) Eur Heart J 37:2129-2200
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
Levosimendan bei Kardiogenem Schock
Zusammenfassung
- Nachweis eines Benefit nur auf wenige kleine Studien beschränkt
- potenzieller Nutzen von Levosimendan als Begleittherapie
- Bevorzugung ggü. PDE 3-Inhibitoren
- nur mit äußerster Vorsicht anzuwenden
- hohe Therapiekosten
Einsatz von Inotropika/ vasoaktiven Substanzen
Empfehlungen der ESC-Guidelines von 2008
derzeitiger Konsens:
Noradrenalin und Dobutamin als Mittel der ersten Wahl im kardiogenen Schock
| Dobutamin | Klasse IIa-Empfehlung, Evidenzgrad C |
| Dopamin: | Klasse IIb-Empfehlung, Evidenzgrad C |
| Arterenol: | Klasse IIb-Empfehlung, Evidenzgrad C * |
| PDE 3-Hemmer: | Klasse IIb-Empfehlung, Evidenzgrad C |
| Levosimendan: | Klasse IIb-Empfehlung, Evidenzgrad C |

* IKS-Leitliniengruppe: Evidenzgrad 1+
Dickstein K et al. (2008) Eur Heart J 29:2388-2442Møller MH et al. (2016) Acta Anaesthesiol Scand 60:1347-1366.
Murray MC et al. (2012) Eur Heart J 33:1787-1847
Ponikowski P et al. (2016) Eur Heart J 37:2129-2200
Schuhmann J et al. (2018) Cochrane Database Syst Rev 1:CD009669
Werdan K et al. (2019) AWMF LL Infarkt-bedingter kardiogener Schock
mechanische Kreislaufunterstützung
(mechanical circulatory support, MCS)
wenn möglich, bereits im Herzkatheter parallel zur Revaskularisation, Auswahl richtet sich nach den spezifischen Charakteristika des Kreislaufversagens
- perkutan
- bettseitig
- intraaortale Gegenpulsation (IABP)
- VA-ECMO
- nicht bettseitig
- Impella 2.5 [Abiomed®]
- Impella RP [Abiomed®]
- TandemHeart [CardiacAssist®]
- bettseitig
- chirurgisch
- Impella 5.0 [Abiomed®]
- VA-ECMO
perkutan eingeführte mechanische Assist devices
Flussraten in l/min.




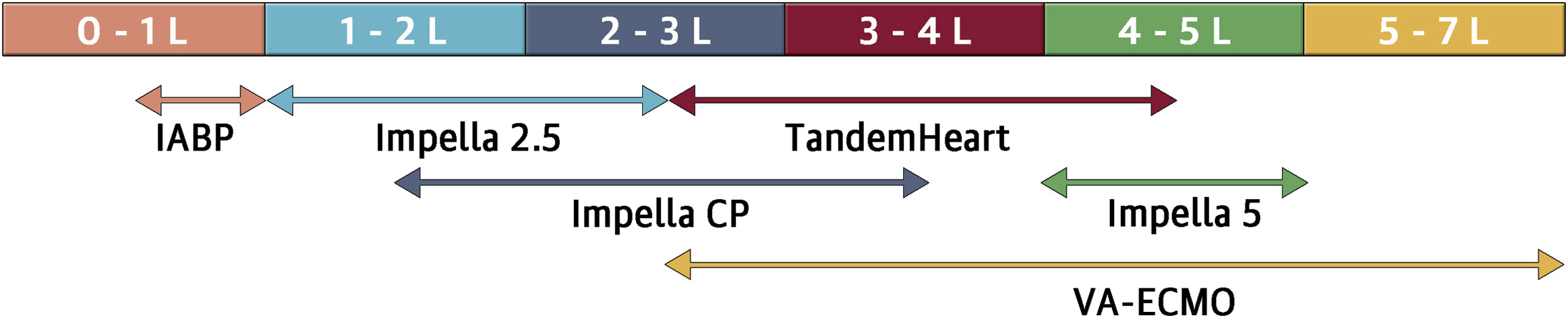 Atkinson TM et al. (2016) JACC Cardiovasc Interv 9:871-883
Atkinson TM et al. (2016) JACC Cardiovasc Interv 9:871-883
mechanische Assist devices
Studienlage
- begrenzte Rekrutierung an Patienten mit ursächlichem akuten Myokardinfarkt
- Interpretation durch fehlende Daten über signifikante Komplikationen eingeschränkt
- wie Blutungen, Ischämie der Gliedmaßen, akute Nierenverletzungen und Hämolyse
- mögliche Selektionsverzerrung der Zentren durch Einschluss von Patienten mit kaum abnormaler Hämodynamik
- auch ohne frühe mechanische Kreislaufunterstützung möglicherweise gute Prognose
- bislang keine prospektive, randomisierte, mehrarmige Studien mit verschiedenen Optionen der perkutanen mechanischen Kreislaufunterstützung
Jones TL et al. (2019) Open Heart 6:e000960
mechanische Assist devices
verbleibende Fragen
- Zeitpunkt und -fenster des Einsatzes?
- Verwendung strenger hämodynamischer Definitionen?
- Einsatz außerhalb eines akuten Koronarsyndroms?
- LV-Unterstützungssysteme ausreichend?
- lediglich Verbesserung der Hämodynamik ohne Beeinflussung der Mortalität?
Jones TL et al. (2019) Open Heart 6:e000960

kardiogener Schock
Zusammenfassung
die Schlüssel zur Behandlung des (Infarkt-bedingten) kardogenen Schocks
- Früherkennung
- hämodynamische Beurteilung
- Koronarrevaskularisierung der Culprit-lesion
- überlegter Einsatz mechanischer Kreislaufunterstützung
- Behandlung durch Expertenteam
 circulus vitiosus (Abwärtsspirale)
circulus vitiosus (Abwärtsspirale)
