echo-intensiv
kardiale Auswirkungen von COVID-19
Einleitung
Seit seiner Entdeckung im Dezember 2019 hat sich die durch das SARS-CoV-2 (Severe acute respiratory syndrome coronavirus 2) verursachte COVID-19 weltweit rasch ausgebreitet und eine Pandemie verursacht. Die schwere SARS-CoV-2-Infektion kann nicht nur zu einer beidseitigen interstitiellen Pneumonie (bis hin zum ARDS) führen, sondern hat erhebliche Morbiditäts- und Mortaliäts-steigernde kardiovaskuläre Auswirkungen. Die Beziehung zwischen der SARS-CoV-2-Infektion und kardiovaskulärer Erkrankungen sind komplex und bisher wenig verstanden (Stand 17.05.2020). Auf der einen Seite zählen die kardiovaskulären Komplikationen zu den schwerwiegendsten von COVID-19 auf der anderen Seite sind kardiovaskuläre Komorbiditäten bei schwer COVID-19-Erkrankten häufig.1
Warum KHK-Patienten schwerer betroffen sind
Das Auftreten von Herz-Kreislauf-Erkrankungen korreliert im Allgemeinen mit zunehmendem Lebensalter und den
bekannten Risikofaktoren wie männliches Geschlecht, Diabetes mellitus, arterielle Hypertonie und Adipositas.
Diese Patienten sind es, die mit mit höherer Wahrscheinlichkeit einen schweren COVID-19-Verlauf nehmen.2,3,4
Es wurde in China über eine 5-fache Mortalitätssteigerung (10,5%, nicht altersbereinigt) bei Vorliegen einer
kardiovaskulären Erkrankung im Rahmen von COVID-19 berichtet.5
Die höhere Mortalität von Patienten mit kardiovaskulären Begleiterkrankungen kann daher direkt auf die
zugrundeliegende kardiovaskuläre Erkrankung zurückzuführen sein oder lediglich mit dieser einhergehen. Daneben
kann die gesehene kardiovaskuläre Erkrankung auch Zeichen für beschleunigte Alterungsprozesse, Dysregulation des
Immunsystems oder andere Mechanismen im Rahmen von COVID-19 sein.6
Patienten mit vorbestehender kardiovaskulären Erkrankungen sind für eine Ansteckung mit SARS-CoV-2 nicht anfälliger,
jedoch anfälliger für die Entwicklung schwerwiegenderer Komplikationen.7 Es kommen mehrere
potenzielle Mechanismen in Betracht weswegen Patienten mit einer kardiovaskulären Erkrankung häufiger von einer
schweren COVID-19 Verlaufsform betroffen sind.
Neben direkten und indirekten SARS-CoV-2-bedingten myokardialen Schädigungen kardiovaskulär Erkrankter sind unter
anderem kardiovaskuläre Nebenwirkungen der COVID-19-Therapie und Auswirkungen auf die kardiovaskuläre Versorgung
von COVID-19-Patienten im Rahmen der Pandemie zu diskutieren.8
Myokardiale Schädigung bei COVID-19
Im Krankenhaus versorgte COVID-19 Patienten weisen in 12-28% der Fälle eine über ein erhöhtes kardiales Troponin
definierte myokardiale Schädigung auf.9,10,11,12
COVID-19-Patienten mit kardiovaskulären Vorerkrankungen besitzen hierbei gegenüber Nicht-Vorerkrankten eine vierfach
erhöhte Wahrscheinlichkeit erhöhter kardialer Troponinspiegel (54.5% vs 16%).10 Erhöhte
Troponinwerte sind mit größerer Wahrscheinlichkeit mit einem schweren Krankheitsverlauf und höheren
Krankenhausmortalität assoziiert.7,9,10,12,13,14,15,16
Ein letal endender COVID-19-Krankheitsverlauf weist dabei gegenüber einem nicht-letalem einen höheren und bis zum
Tod anhaltenden Anstieg des kardialen Troponins auf.12
Im Speziellen zeigte sich bei Nachweis einer Erhöhung des kardialen Troponins eine Steigerung des Anteils derer die
invasiv werden mussten um das 5-fache (22,0% vs. 4,2%) und derer die nicht-invasiv beatmet werden mussten um das
11-fache (46,3% vs. 3,9%) gegenüber denen ohne Auffälligkeiten des kardialen Troponins erhöht. Patienten mit
myokardialer Beteiligung besitzen eine 11-fache (51,2% vs. 4,5%) höhere Mortalität als Patienten ohne kardiale
Schädigung.7 Patienten mit ungünstigem Verlauf von COVID-19 sind zwar überpropotional häufig
von vorbestehenden kardiovaskulären Erkrankungen betroffen, aber auch unabhängig von der Vorgeschichte
kardiovaskulärer Erkrankungen traten eine akute Myokardschädigung (ca. 75%) und eine akute Herzinsuffizienz
(ca. 50%) bei verstorbenen Patienten mit COVID-19 signifikant häufiger auf.14 Erhöhte kardiale
Troponin-Spiegel T oder I (cTnT bzw. cTNI) und das Vorliegen einer koronaren Herzkrankheit sind somit voneinander
unabhängige Risikofaktoren eines ungünstigen COVID-19-Verlaufs.17
In der weiteren Differenzierung zeigte sich, dass die Krankenhausmortalität bei COVID-19 bei Patienten ohne
vorbestehende kardiovaskulärer Erkrankung und unauffälligem cTnT bei rund 8%, bei vorbestehender vorbestehender
kardiovaskulärer Erkrankung ohne kardiale Troponin-Erhöhung bei 13%, bei Patienten ohne vorbestehende kardiovaskuläre
Erkrankung aber mit kardialer Troponinerhöhung bei 38% und bei Patienten die beides aufweisen bei 69% liegt.10
 Abb.: Assoziation der Krankenhausmortalität von vorbestehender kardiovaskulärer Erkrankung und Erhöhung des
kardialen Troponin Ts nach Guo T et al. (2020)10
Abb.: Assoziation der Krankenhausmortalität von vorbestehender kardiovaskulärer Erkrankung und Erhöhung des
kardialen Troponin Ts nach Guo T et al. (2020)10
Das cTnT weist dabei eine signifikante lineare Korrelation mit dem C reaktiven Protein (CRP) und dem
N-terminalen Pro-Brain-Natriuretischen Peptid (NT-proBNP) auf. Bei Patienten deren Erkrankung einen
ungünstigen Verlauf nimmt steigt im Gegensatz zu denen die einen günstigen Verlauf aufweisen das cTnT
und das NT-proBNP-Spiegel während des Aufenthalts signifikant an.10
Mechanismen der myokardialen Schädigung
Es werden verschiedene ursächliche Mechanismen COVID-19-assoziierter Myokardschädigungen diskutiert.18,19
Diese orientieren sich an den bekannten Ursachen einer kardialen Troponierhöhung kritisch Kranker20,21,22,23
und auf frühere Beobachtungen die im Rahmen der Ausbrüche des schweren akuten respiratorischen Syndroms (SARS) und
des respiratorischen Syndroms im Nahen Osten (MERS) gemacht wurden.24,25
Die verfügbaren Daten für COVID-19 sind derzeit noch gering.
Obwohl COVID-19 vordergründig eine Erkrankung der unteren Atemwege darstellt, ist sie als Multiorganerkrankung
aufzufassen, die nicht nur die Lunge sondern auch andere Organe insbesondere Darm und das Herz-Kreislauf-System
betrifft. Hierbei spielt die ACE2/Ang-(1-7)/MasR-Achse, die eine Komponente des Renin-Angiotensin-Aldosterin-Systems
ist eine tragende Rolle.26 Die ACE2/Ang-(1-7)/Mas-Achse stellt einen Gegenregulator der ACE-Ang
II-AT(1)-Rezeptor-Kaskade dar.27
ACE2 ist ein Transmembranprotein. Es gibt zwei Formen des ACE2-Proteins: die zelluläre (membrangebundene) Form und
die zirkulierende (lösliche) Form.28 Das zelluläre ACE2-Protein ist das vollständige Protein.
Dieses wird in Pneumozyten und Enterozyten des Dünndarms reichlich aber aber unter anderem auch in vaskulären
Endothelzellen des Herzens exprimiert.29,30 Das zirkulierende ACE2
wird konkurrierend durch die Metalloprotease ADAM17 oder durch die Transmembranserinprotease vom Typ II, TMPRSS2
vom Zellmembran-ständigen ACE abgespalten.31 TMPRSS2 spaltet ACE2 jedoch anders als ADAM17.
Das durch TMPRSS2-gespaltene ACE2 dient Viren wie SARS-CoV-2 als Bindungsrezeptor um in die Zellen von Lunge und
Darm einzudringen. Wenn das Immunsystem nicht in der Lage ist, die Infektion abzuwehren, wird SARS-CoV-2 massiv
repliziert, unterdrückt die Bildung zellulären ACE2, zerstört die Wirtszelle und führt zur Vermehrung von SARS-CoV-2
im Organismus.32 In Gang geraten kommt es zur Initiierung einer systemischen
Inflammationsreaktion mit Zytokinsturm und konsekutiver Multiorgandysfunktion.
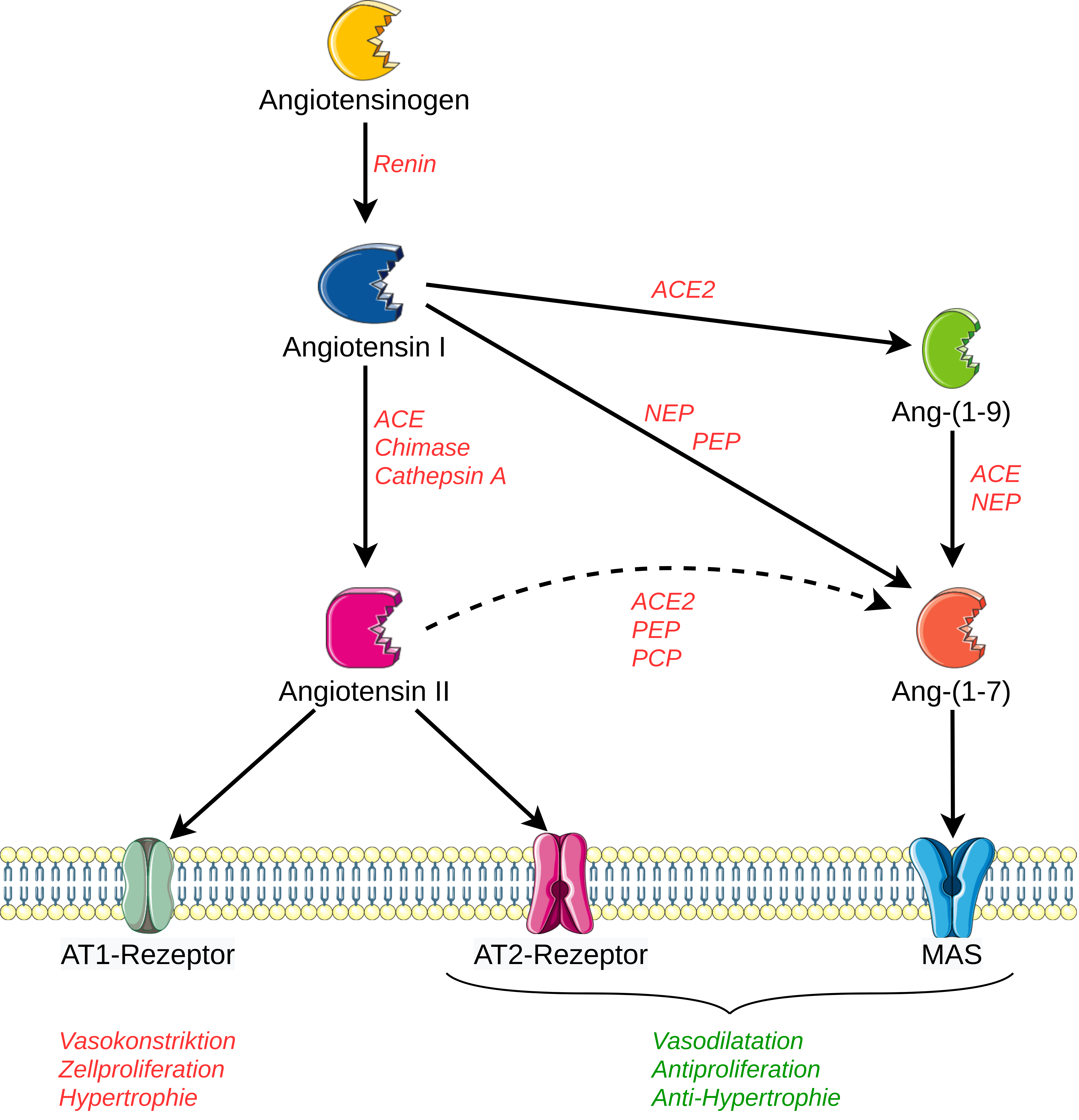 Abb.: Die verschiedenen Achsen des Renin-Angiotensin-Aldosteronsystem nach Santos RA et al. (2008)27
mit deren vereinfachten Darstellung der ACE-Ang II-AT(1)- und der ACE2/Ang-(1-7)/Mas-Achse.
Abb.: Die verschiedenen Achsen des Renin-Angiotensin-Aldosteronsystem nach Santos RA et al. (2008)27
mit deren vereinfachten Darstellung der ACE-Ang II-AT(1)- und der ACE2/Ang-(1-7)/Mas-Achse.
Abkürzungen: ACE= Angiotensin-Converting Enzyme, ACE2= Angiotensin-Converting Enzyme 2, Ang(1–7) Rezeptor Mas,
Mas=NEP= Neutral‐Endopeptidase 24.11 (=Enkephalinase), PCP= Prolyl‐Carboxypeptidase, PEP= Prolyl‐Endopeptidase
(Grafiken modifiziert von Servier Medical Art, lizenziert unter einer Creative Common Attribution 3.0 Generic
License. http://smart.servier.com/)
Systemische Inflammation (Zytokin-Sturm)
Bei Gesunden schränkt Ang-1-7 der ACE2/Ang-(1-7)/MasR-Kaskade des Renin-Angiotensin-Aldosterons die Synthese von pro-inflammatorischen und pro-fibrotischen Zytokinen ein. Eine durch SARS-CoV-2 bewirkte Downregulation von ACE2 mit konsekutiver Senkung der Ang-1-7-Spiegel könnte so zur Hochregulation pro-inflammatorischer Zytokine mit nachfolgender unkontrollierter, fulminanten Entzündungsreaktion führen.10,33 Passend hierzu zeigte sich eine signifikante lineare Korrelation zwischen dem kardialen Troponin und dem C-reaktiven Protein, was zumindest darauf hindeutet, dass eine Myokardschädigung eng mit der Entzündungspathogenese assoziiert ist.10
COVID-19 und das Renin-Angiotensin-Aldosteron-System
Das Angiotensin Converting Enzyme 2 (ACE2) bewirkt wie erwähnt im Renin-Angiotensin-Aldosteron-System die Umwandlung
von Angiotensinogen-II (Ang-II) in Angiotensin-1-7, das den vasokonstriktorischen, pro-inflammatorischen,
prooxidativen, proproliferativen und profibrotischen Wirkungen des Ang-II entgegenwirkt.34
SARS-CoV-2 nutzt wie SARS-CoV den TMPRSS2 gespaltenen zirkulierenden ACE2 als funktionellen Rezeptor zum Eintritt
in die Wirtszelle und reguliert in der Folge ihrer Replikation die ACE2-Expression soweit herunter, dass ACE2 das
schädliche Ang-II nicht mehr spalten kann.35,36,37
Wird ACE2 gehemmt kann Ang-II seine Wirkung frei entfalten und eine Gefährdung bei Patienten mit COVID-19 darstellen.
ACE2-Rezeptoren sind jedoch nicht nur in Herz und Lunge sondern auch und in den Nieren, Gefäßendothelzellen und im
Gastrointestinaltrakt lokalisiert.38 Das könnte ein multiples Organversagen bei einigen
COVID-19-Patienten erklären. Die Bedeutung eines Ang-II/Ang-1-7-Ungleichgewichts bei COVID-19 wird aufgrund
begrenzter Daten jedoch von dem eng verwandten SARS-CoV abgeleitet. Die klinische Bedeutung dieses Signalwegs bei
schweren COVID-19-Verläufen und die mögliche Rolle der therapeutischen Beeinflussung dieses Rezeptors sind derzeit
noch nicht vollständig bekannt.39 Rekombinantes ACE2 könnte so wird derzeit diskutiert konkurrierend
den Eintritt von SARS-CoV2 in die Wirtszelle reduzieren und die ACE2-Aktivität und dessen positive Wirkung
wiederherstellen.40 Derzeit bleibt hier das Ergebnis der derzeit diesbezüglichen Studie über die
Verwendung von rekombinanten humanen ACE2 in der Behandlung von COVID-19 abzuwarten (NCT04335136).41
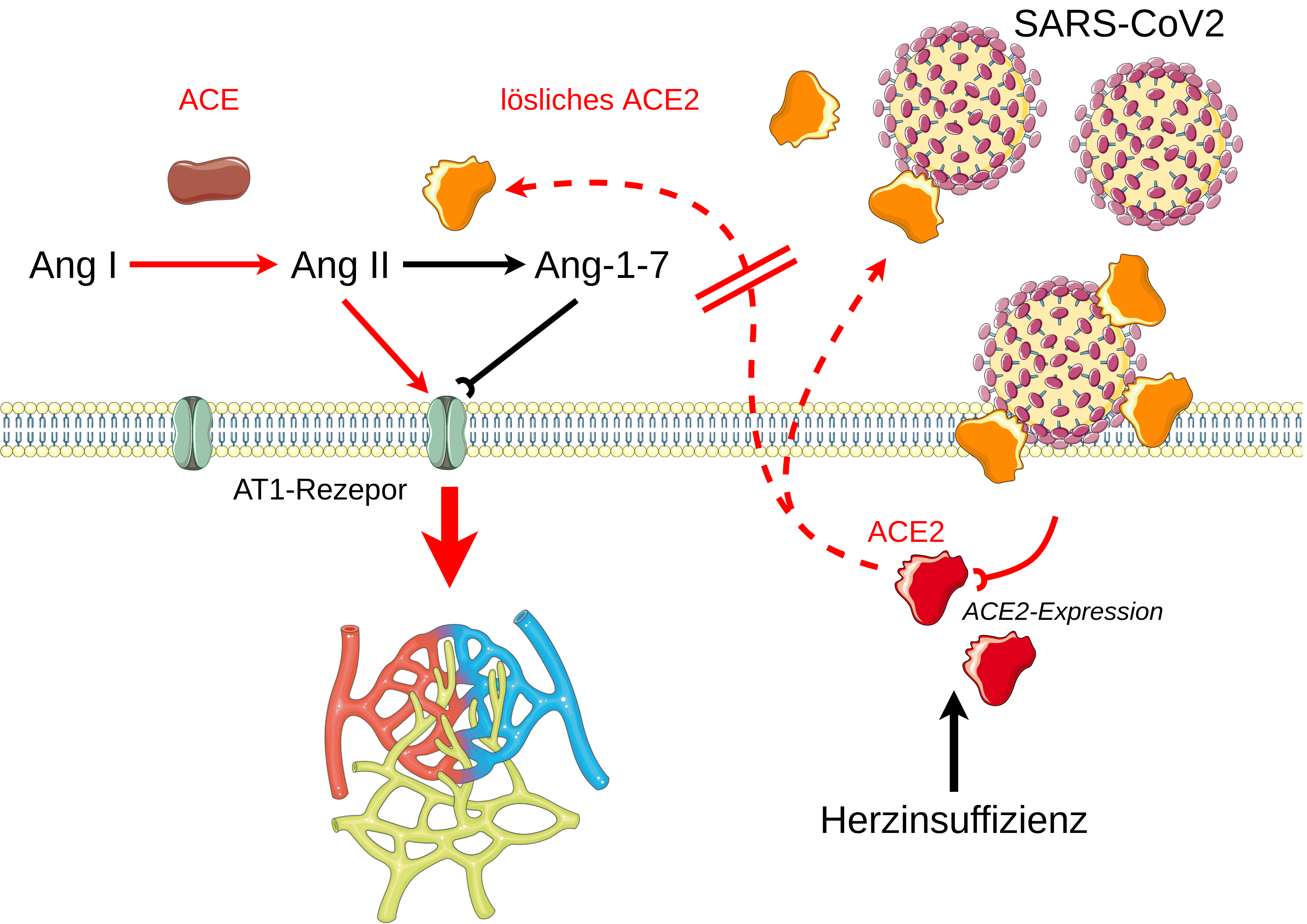 Abb.: Schematische Darstellung der Störung des Gleichgewichts zwischen Ang II und Ang-1-7 durch Infektion mit
SARS-CoV-2. ACE= Angiotensin-Converting Enzym, ACE2= Angiotensin-Converting Enzym 2, Ang I= Angiotensin I,
AngII =Angiotensin; Ang-(1-7)= Angiotensinogen-1-7, AT1 =Angiotensin Typ-1-Rezeptor, Pfeil rot = die
Mikrozirkulation schädigender Einfluss, Pfeil schwarz= auf die Mikrozirkulation protektiv wirkender Einfluss.
Abb.: Schematische Darstellung der Störung des Gleichgewichts zwischen Ang II und Ang-1-7 durch Infektion mit
SARS-CoV-2. ACE= Angiotensin-Converting Enzym, ACE2= Angiotensin-Converting Enzym 2, Ang I= Angiotensin I,
AngII =Angiotensin; Ang-(1-7)= Angiotensinogen-1-7, AT1 =Angiotensin Typ-1-Rezeptor, Pfeil rot = die
Mikrozirkulation schädigender Einfluss, Pfeil schwarz= auf die Mikrozirkulation protektiv wirkender Einfluss.
(Grafiken modifiziert von Servier Medical Art, lizenziert unter einer Creative Common Attribution 3.0 Generic
License. http://smart.servier.com/)
kardiale Auswirkungen
Es scheinen hohe Zytokinkonzentrationen der Schlüsselfaktor für die Myokardschädigung bei COVID-19 zu sein, da sie
mit direkter Myokardverletzung, endothelialer Dysfunktion, Destabilisierung der koronaren Plaque und
Mikrothrombogenese in Zusammenhang stehen.4 Aber auch eine direkte virale Schädigung der
Kardiomyozyten wird diskutiert.
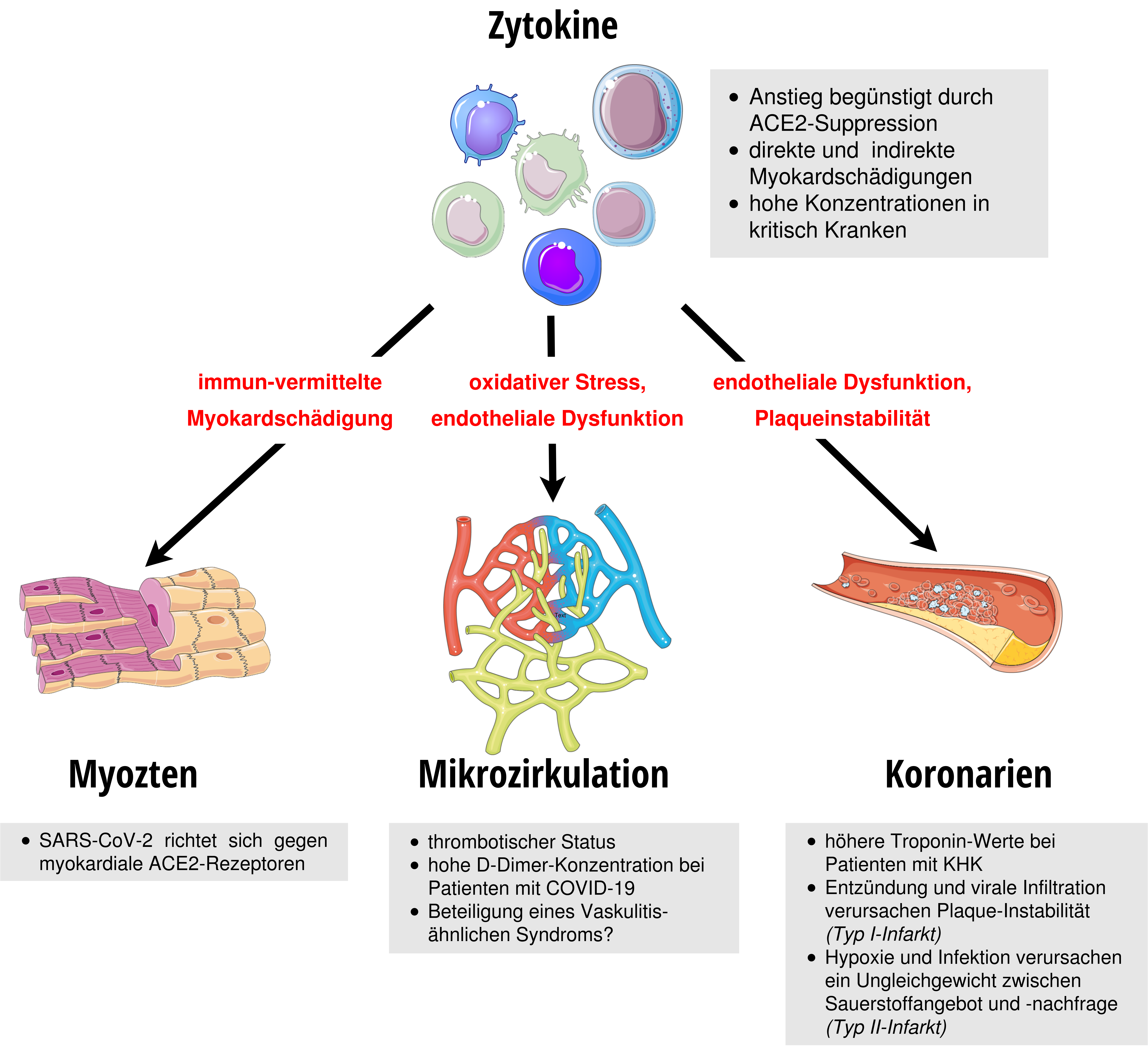 Abb.: Aktuell diskutierte Mechanismen der myolardialen Schädigung bei COVID-19.
Abb.: Aktuell diskutierte Mechanismen der myolardialen Schädigung bei COVID-19.
(Grafiken modifiziert von Servier Medical Art, lizenziert unter einer Creative Common Attribution 3.0 Generic
License. http://smart.servier.com/)
Myokarditis
Eine Myokarditis wird als Entzündung des Herzmuskels definiert, die nach etablierten histologischen, immunologischen
und immunhistochemischen Kriterien diagnostiziert wird.42 Die pathologische Auswertung von
Myokardbiopsien durch histologische Begutachtung, Immunhistochemie und molekularen Testmethoden ist die
Schlüsselkomponente in der Diagnose, Behandlung und dem Verständnis der Myokarditis.43
Zahlreiche Viren binden direkt an molekulare Zielstrukturen im Myokard (= kardiotrope Viren). Entstehende
Myokardschädigungen können durch unterschiedliche Mechanismen bedingt sein. In der Initialphase der viralen
Myokarditis kommt es zu einer direkten virusvermittelten Lyse der Kardiomyozyten.44 Dieser folgt
in der Regel eine starke T-Zell-Antwort, die zu einer weiteren Myokardschädigung führen kann.
Bei COVID-19 zeigte sich, dass das ACE2 als funktioneller Rezeptor für SARS-CoV-2 dient, um in die Wirtszelle
einzudringen.45 Nach Eindringen in die Wirtszelle reguliert SARS-CoV-2 die ACE2-Expression herunter.
ACE2 wird in den Perizyten des Herzens Erwachsener hoch expremiert, was auf eine intrinsische Empfindlichkeit des
Herzens für eine SARS-CoV-2-Infektion hindeuten könnte. Patienten mit einer vorbestehenden Herzinsuffizienz weisen
zudem eine gesteigerte ACE2-Expression auf.46 Die Schädigung der Perizyten durch die Virusinfektion
kann zu einer Dysfunktion der kapillaren Endothelzellen führen, die dann eine mikrovaskuläre Dysfunktion auslöst.
Veröffentlichte Berichte zu histologisch bestätigten COVID-19-Myokarditiden sind bislang rar.47
Dies liegt unter anderem an der Zurückhaltung gegenüber Autopsien bei schweren Infektionskrankheiten.48,49
SARS-CoV-2 ist einer hohen Gefahrengruppe zugeordnet.51 Die histopathologischen Befunde in einem
einzigen Fallbericht zeigte diffuse T-lymphozytäre entzündliche Infiltrate mit interstitiellem Ödem und begrenzten
Nekroseherden, wobei jedoch keine SARS-CoV2-Viruspartikel dokumentiert worden sind.50 In einem
anderen Fall mit schweren COVID-19-Verlauf wies die Histologie interstitielle mononukleäre Entzündungsinfiltrate
des Myokards auf. 47 In einer anderen Fallstudie an 3 Patienten wurden mittels RT-PCR
SARS-CoV-2-Viruspartikel im Herzgewebe identifiziert.52 Das Bild einer fulminanten Myokarditis,
die als plötzliche und schwere Entzündung des Myokards mit Myozytennekrose, umgebenden Ödem und konsekutivem
kardiogenen Schock definiert ist mit Nachweis von SARS-CoV2-Viruspartikeln lagen in keinem der Fälle vor. Die
Evidenz einer möglichen spezifischen SARS-CoV-2-Myokarditis ist bislang nicht erbracht.53 Es
wird aber vermutet, dass sich die Merkmale einer SARS-CoV-2-Infektion denen der SARS- und MERS-Coronavirus-Infektionen
von 2003 und 2008 ähnlich sind.24,25,54
In allen anderen publizierten Fällen wurde die Verdachtsdiagnose einer COVID-19-assoziierten Myokarditis anhand
klinischer Kriterien oder der subepikardialen späten Gadoliniumanreicherung in der Magnetresonanztomographie unter
Berücksichtigung des kardialen Troponins und der elektrokardiographischen Veränderungen (T-Negativierungen) gestellt.55,56,57,58
Jedoch kann auch eine Stresskardiomyopathie (Takutsubo-Kardiomyopathie), deren Auftreten bei COVID-19 ebenfalls
beschrieben wird, gleichartige Ekg- und echokardiographischen Veränderungen hervorrufen.59 Hier
bleibt die Differenzierung schwierig.
.png) Abb.:Abb.: Histologien des Myokards bislang veröffentlichter Berichte einer Myokarditis unter COVID-19 aus
Sala S et al. (2020)51 und Xu Z et al. (2020)47
Abb.:Abb.: Histologien des Myokards bislang veröffentlichter Berichte einer Myokarditis unter COVID-19 aus
Sala S et al. (2020)51 und Xu Z et al. (2020)47
Störungen der Mikrozirkulation
Eine endotheliale Dysfunktion, ein Zytokinsturm, oxidativer Stress und eine Ang-II-Hochregulierung könnten die bei
schwerer COVID-19 häufig auftretende Koagulopathie erklären.60 Etwa die Hälfte der Patienten mit
COVID-19 weisen hohe D-Dimere auf, die mit der Schwere der Erkrankung und einer höheren Mortalität assoziiert sind.61,62
Die ausgeprägte D-Dimer-Erhöhung könnte auf eine massive Entzündungsreaktion zurückzuführen sein, die eine zunächst
intrinsische Fibrinolyse in der Lunge und dann systemische stimuliert.
Ein in diesem Rahmen bestehender Zusammenhang mit einer Vaskulitis, ist in der Vergangenheit wiederholt diskutiert
worden. In mehreren Studien wurde von einer Verbindung zwischen einer Coronavirus-Infektion und der Kawasaki-Krankheit
berichtet.63,64,65 Auch in einer Fallserie
von SARS-Patienten zeigten sich Befunde einer systemischen Vaskulitis, einschließlich Ödemen, lokalisierter
Fibrinoidnekrose und Infiltration von Monozyten, Lymphozyten und Plasmazellen in Gefäßwände in Herz, Lunge, Leber,
Niere, Nebenniere und quergestreifter Muskulatur.iv Bei SARS-CoV2 wurde dies bislang nicht dokumentiert.
Es wurde auch vermutet, dass mikrovaskuläre Schädigungen des Herzens ähnlich der der Nierenschäden von schweren
COVID-19-Verläufen zu Perfusionsstörungen, Gefäßhyperpermeabilität und Vasospasmen mit der Folge einer
Myokardschädigung führen könnte.66,67,68
Ein sicherer Beleg hierfür ist bislang nicht erbracht worden.
Myokardinfarkt
Es ist bekannt, dass Patienten mit vorbestehender koronarer Herzkrankheit bzw. mit Risikofaktoren für eine
kardiovaskuläre Erkrankung ein erhöhtes Risiko besitzen bei viralen bzw. akuten respiratorischen Infektionen
ein akutes Koronarsyndrom (ACS) zu entwickeln.70,71,72,73
Solches war bislang bei anderen Coronaviren nicht bekannt. SARS-CoV und SARS-CoV-2 scheinen sich anders zu verhalten.18
Es sind zwei Szenarien denkbar.
Der uns bekannte typische, durch eine Plaqueruptur mit Thrombusbildung verursachte Myokardinfarkt vom Typ 1 kann
durch COVID-19 ausgelöst werden.74 Die bei COVID-19 freigesetzten, zirkulierenden Zytokine könnten
hier zu einer atherosklerotischen Plaque-Instabilität und Ruptur führen.75 Zusätzlich kann die
Dämpfung der ACE2-Expression und die damit verbundene Erhöhung von Ang-II das kardiovaskuläre Risiko durch oxidativen
Stress, endotheliale Dysfunktion und Vasokonstriktion steigern.39 Da ACE2 u.a. in den vaskulären
Endothelzellen exprimiert wird, könnte eine direkte virale Infektion Gefäße, die zu einer Plaque-Instabilität führt,
auch bei Patienten mit COVID-19 eine Rolle bei Entwicklung eines Myokardinfarktes Typ 1 spielen.38,76
Eine Hypoxämie bei schwerem COVID-19-Verlauf könnte aufgrund des Ungleichgewichts zwischen Sauerstoffangebot und
-bedarf in Verbindung mit Fieber, Tachykardie und endokriner Dysregulation zu einer myokardialen Ischämie im Sinne
eines Myokardinfarktes vom Typ 2 führen.74 Erschwerend kann sich zudem eine durch die Hypoxämie
bedingten intrazellulären Kalziumüberschuss mit der Folge einer kardialen Myozyten-Apoptose auswirken.69
Es ist daher möglich, dass eine bestehende stabile koronare Herzkrankheit infolge von COVID-19 als Myokardinfarktes
Typ 2 durch die akute Infektion demaskiert wird.39
Interessanterweise sind kaum Berichte über Symptome und EKG-Veränderungen im Zusammenhang mit einem Myokardinfarkt
im Rahmen von COVID-19 veröffentlicht worden.77 Spezifische Ekg-Veränderungen, die auf eine
myokardiale Ischämis hinwiesen wurden in der Regel nicht beschrieben. Auch zeigte sich im Ekg bei Krankenhaus-Aufnahme
bei letalen kardiovaskulären Verläufen keine spezifischen Auffälligkeiten.10 Die unter COVID-19
beschriebenen EKG-Veränderungen umfassen Sinustachykardien, SIQIII-Typ, Rechtsschenkelblockierungen, AV-Blockierungen,
ST-Elevationen und diffuse T-Negativierungen sowie ventrikuläre Tachykardien.78 Sie sind in der
Regel mit einem kritischen Status bei COVID-19 assoziiert. Die EKG-Veränderungen können verschiedene Manifestationen
einer Myokardschädigung widerspiegeln. Sie können Ausdruck einer rechtsventrikulären Belastung, von lokalen
Entzündungen des Myokards bzw. einer akuten Myokarditis wie auch einer myokardialen Infarzierung sein.77
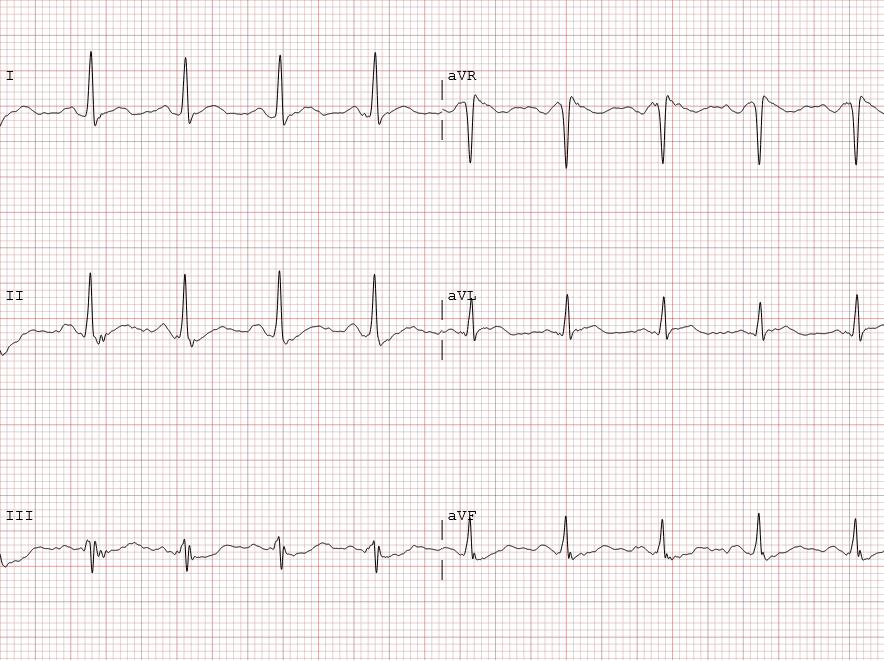
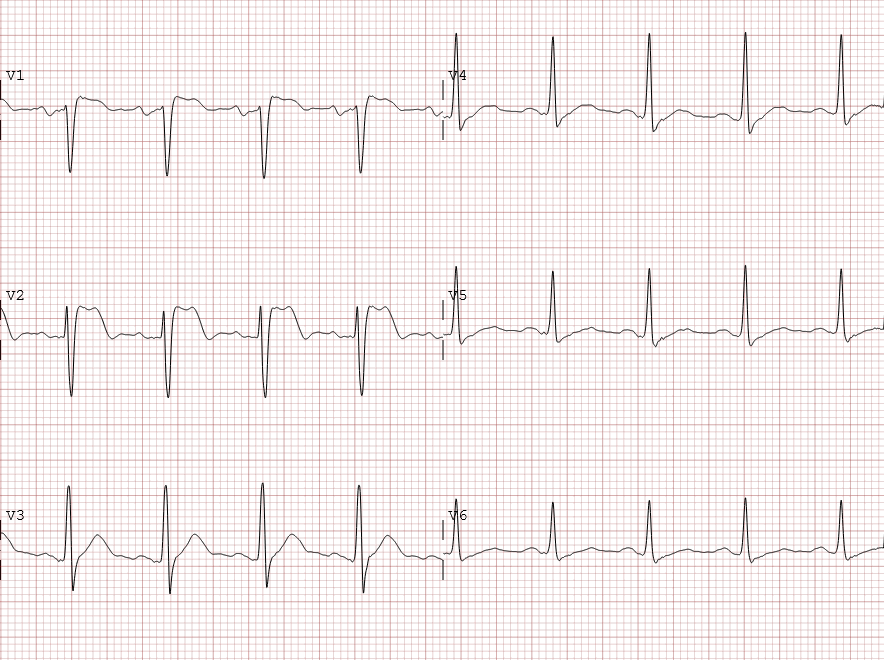 Abb.: 42 jähriger Patient mit hochfebrilen Temperaturen von 40°C bei COVID-19. Elektroardiographisch imponiert
ein Typ 2 Brugada-EKG-Muster. Bei initial und in den Kontrollen unauffälligem kardialen Troponin T kann eine
akute myokardiale Infarzierung sicher ausgeschlossen und eine COVID-19-Myokarditis als unwahrscheinlich angesehen
werden.79 Nach Absenkung der febrilen Temperaturen waren die Ekg-Veränderungen nicht mehr
nachweisbar.
Abb.: 42 jähriger Patient mit hochfebrilen Temperaturen von 40°C bei COVID-19. Elektroardiographisch imponiert
ein Typ 2 Brugada-EKG-Muster. Bei initial und in den Kontrollen unauffälligem kardialen Troponin T kann eine
akute myokardiale Infarzierung sicher ausgeschlossen und eine COVID-19-Myokarditis als unwahrscheinlich angesehen
werden.79 Nach Absenkung der febrilen Temperaturen waren die Ekg-Veränderungen nicht mehr
nachweisbar.
Über das Auftreten akuter Koronarsyndrome und Myokardinfarkte wurde auch während des ersten SARS-Ausbruchs 2003
berichtet.80 Es zeigte sich auch hier, dass die Infektion mit SARS-CoV ebenso wie SARS-CoV2 ein
klinisch wesentlich breiteres klinisches Spektrum als eine alleinige atypische Lungenentzündung aufwies.
Ausblick
Derzeit kann keiner der beschriebenen Mechanismen definitiv als Hauptursache für eine Troponinerhöhung und/oder
Myokardschädigung bei Patienten mit COVID-19 identifiziert werden. Vieles spricht dafür, dass viele Faktoren
beteiligt sind. Durch ein Ungleichgewicht des Renin-Angiotensin-Aldosteron-Systems scheint das Herz-Kreislauf-System
früh in Mitleidenschaft gezogen zu werden und dies durch eine systemische Inflammationsreaktion, endotheliale
Dysfunktion und mikrovaskuläre Schädigung aggraviert wird.
Das kardiale Troponin stellt nicht nur bei Patienten mit bekannter kardiovaskulärer Vorerkrankung bei COVID-19 einen
nützlichen prognostischen Marker dar, um ggf. frühzeitig eine aggressivere Behandlung einzuleiten. Es erscheint
sinnvoll bei COVID-19-Patienten das kardiale Troponin als Prognoseparameter bereits bei Krankenhausaufnahme und im
Verlauf zu bestimmen.
Die Berurteilung einer kardialen Troponin-Erhöhung bei COVID-19-Patienten sollte auf der Grundlage der Schwere einer
bestehenden systemischen Inflammation erfolgen.81 Das weitere therapeutische ggf. invasive
kardiologische Vorgehen ist hiervon abhängig.
Literatur [verlinkt]
