echo-intensiv
Die Beurteilung der diastolischen Funktion
Parameter
„Are the currently available diastolic parameters a bunch of meaningless numbers or crucial information in the
treatment of patients?“1
Die diastolische Funktion ist eine komplexe Abfolge mehrerer miteinander verzahnter Prozesse. Zur Beurteilung
der diastolischen Funktion sind eine Vielzahl verschiedenster Kenngrößen vorgeschlagen worden.2
Der erste akzeptierte Parameter in der Bewertung der diastolischen Funktion war das durch Doppler-
Geschwindigkeitsmessungen ermittelte Füllungsmuster (E/A-Ratio) über den Mitralklappen. Es spiegelt den Gradienten
zwischen dem linken Vorhof (LA) und dem linken Ventrikel (LV) in der Diastole wider. Die ausgesprochene
Vorlastabhängigkeit der E/A-Ratio sowie die Unverlässlichkeit bei Tachykardie, bei diastolischer Dysfunktion mit
mäßig erhöhten LA-Drücken und weiteren Aspekten führten zur Suche nach solideren Parametern wie der mittels
Gewebedoppler (Tissue doppler imaging =TDI) gewonnenen E/e‘-Ratio.1 Aber auch die
E/e‘-Ratio ist nicht geeignet als einzelner Wert Veränderungen des linksventrikulären Füllungsdrucks bei Patienten
mit HFpEF sicher zu erkennen.3,4,5
Alle Parameter sind in der Gesamtheit zu interpretieren. Ein einzelner Wert kann die Diagnose weiterhin nicht sicher
stellen. Die Suche geht aber weiter und führt zu Verfeinerungen der bisherigen und Entwicklung neuer
Untersuchungsmethoden wie der Schlagvolumen-bezogenen E/e'-Ratio (E/e'/SV mit einem Cut-off >0.40), der E/a‘-Ratio
(Cutt-off >14) und des Speckle-Tracking.6,7,8,9
Zu beachten ist, dass bestimmte kardiale Erkrankungen (Rhytmusstörungen wie Vorhofflimmern, Klappenerkrankungen u.a.)
die normalen physiologischen Abläufe und die verschiedenen kardialen Indices erheblich beeinflussen können. In dieser
Situation ist die Beurteilung der diastolischen Dysfunktion besonders schwierig.
Parameter des Algorytmus der ASE/EACI
In dem von der American Society of Echocardiography und der European Association of Cardiovascular Imaging vorgeschlagenen Algorytmus zur Beurteilung der diastolischen Funktion fließen fünf Parameter ein.10
E/A-Ratio: Mitralklappeneinstrom
Die Beurteilung des Einstroms über der Mitralklappe besitzt für die Einschätzung der diastolischen Dysfunktion bei
Patienten mit reduzierter EF oder struktureller Herzerkrankung große Bedeutung. Das Mitraleinstromprofil im
pw-Doppler veranschaulicht die verschiedenen Phasen der Füllung und lässt deren Beitrag erkennen.
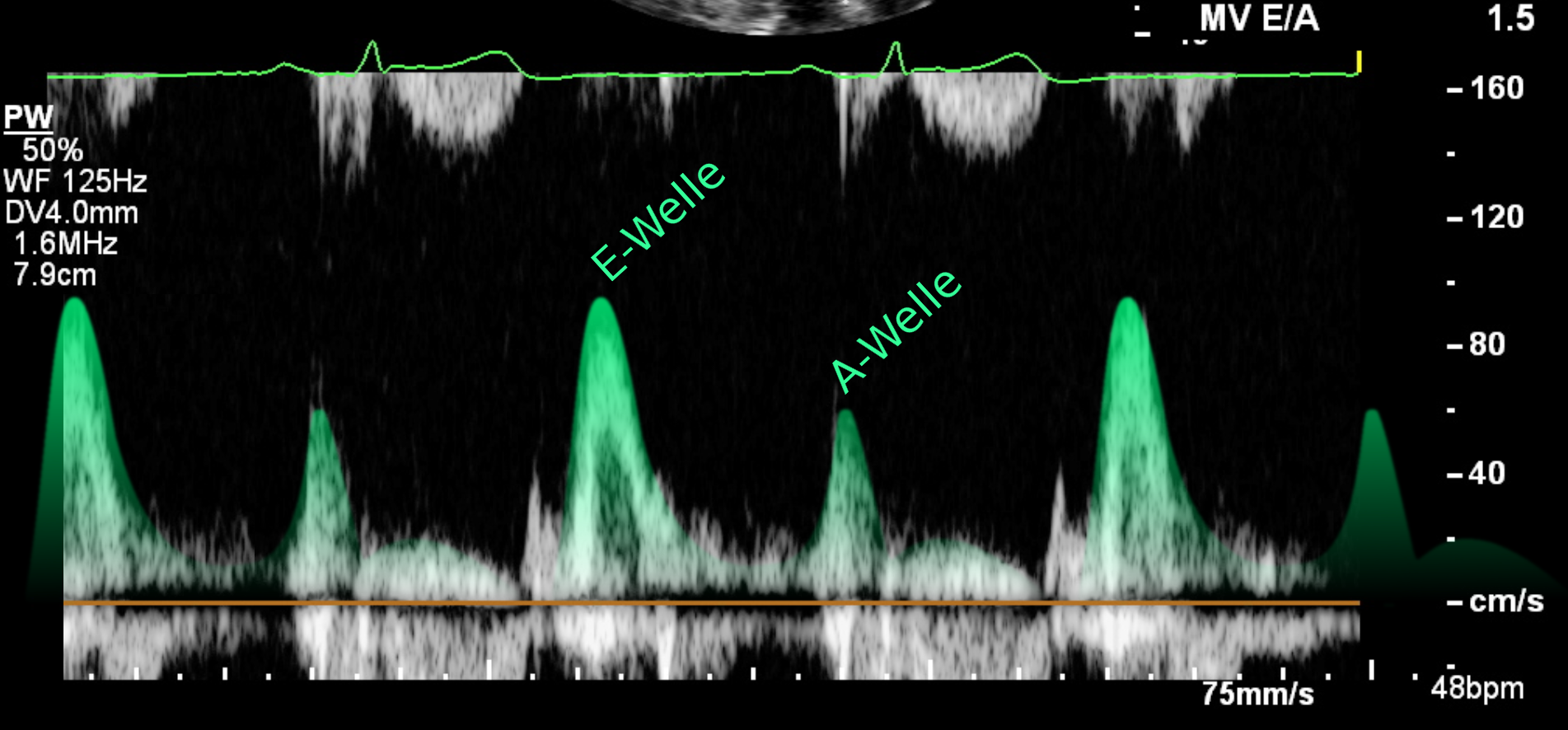 Abb.: Die E- und A- Welle im Einstromprofils über der Mitralklappe im pw-Doppler
Abb.: Die E- und A- Welle im Einstromprofils über der Mitralklappe im pw-Doppler
Die E-Welle entsteht durch die diastolische Relaxation des linken Ventrikels, wodurch ein Sog und damit ein Einstrom
von Blut (frühe diastolische Füllung) aus dem linken Vorhof bewirkt wird. Die A-Welle entsteht durch die aktive
Vorhofkontraktion (späte diastolische Füllung).
Der Einstrom über der Mitralklappe reflektiert den Druckunterschied zwischen Vorhof und Ventrikel wider. Jede
Veränderung des intraventrikulären diastolischen Drucks wirkt sich auf die Einstromgeschwindigkeit und damit auf die
Form des Einstromsignals im pw-Doppler aus. Eine diastolische Dysfunktion verändert insbesondere die Höhe des
maximalen frühen Einstroms (E-Welle) ,das Verhältnis zwischen früher und später Füllung (E/A-Ratio), die Zeit
der Abnahme der Fließgeschwindigkeit in der frühen Diastole (Dezelerationszeit der E-Welle = DT) und die Zeit bis
zum Beginn der Füllung des Ventrikels nach der Ventrikelrelaxation (isovolumetrische Relaxationszeit = IVRT).
Besonders junge und körperlich aktive Menschen weisen während der Diastole eine rasche, kräftige Relaxation des
Ventrikels (positiv lusitrope Funktion) auf. Hierdurch kann eine sehr hohe E-Welle auftreten. Da hierdurch der
größte Teil des Vorhofvolumens bereits in dieser Phase in den Ventrikel geflossen ist, fällt der darauf folgende
durch die Vorhofkontraktion (=A-Welle) bedingte Einstrom gering aus. Hierbei kann ein nicht pathologisches
E/A-Verhältnis von >2 entstehen (supernormale diastolische Funktion) welches einem restriktiven Füllungsmuster ähnelt.
Es ist jedoch die IVRT (<100 ms) stets normal.11
Anhand der E/A-Ratio des Einstromprofils über der Mitralklappe lässt sich eine Diastolische Dysfunktion nicht sicher
erkennen. Die Beachtung der E/A-Ratio ist jedoch ein wichtiger Parameter in der Schweregradeinteilung der
Diastolischen Dysfunktion.
e‘lateral und e‘septal
Das im Gewebedoppler (Tissue doppler imaging = TDI) bestimmte e‘ spiegelt die maximalen Geschwindigkeit der frühen
myokardialen Relaxation zu dem Zeitpunkt wider, an dem sich der Mitralanulus in der frühen schnellen LV-Füllung von der
Apex entfernt. e' kann von apikal prinzipiell an jedem beliebigen Punkt des Mitralanulus abgeleitet werden, wobei die
Bestimmung am lateralen (e‘lateral und septalen (e‘septal Anulus standardisiert ist. Aufgrund der
unterschiedlichen Orientierung der Myokardfasern und der Nähe zu den kollagenen Fasern der Ventilebene sind die lateralen
Werte etwas etwas höher als septalen.
Die Werte sind altersabhängig. Bei Kindern und gesunden jungen Erwachsenen kann e‘lateral >20 cm/s betragen.
Bei Erwachsenen >30 Jahre ist e‘ >12 cm/s mit einer normalen diastolischen LV-Funktion assoziiert.12
Werte von e‘lateral <=8 cm/s deuten bei mittleren bis älteren Erwachsenen auf eine gestörte LV-Relaxation
hin.11 Im Gegensatz zum Mitraleinströmmuster ist e' stabil gegenüber Änderungen des Füllungsdrucks.
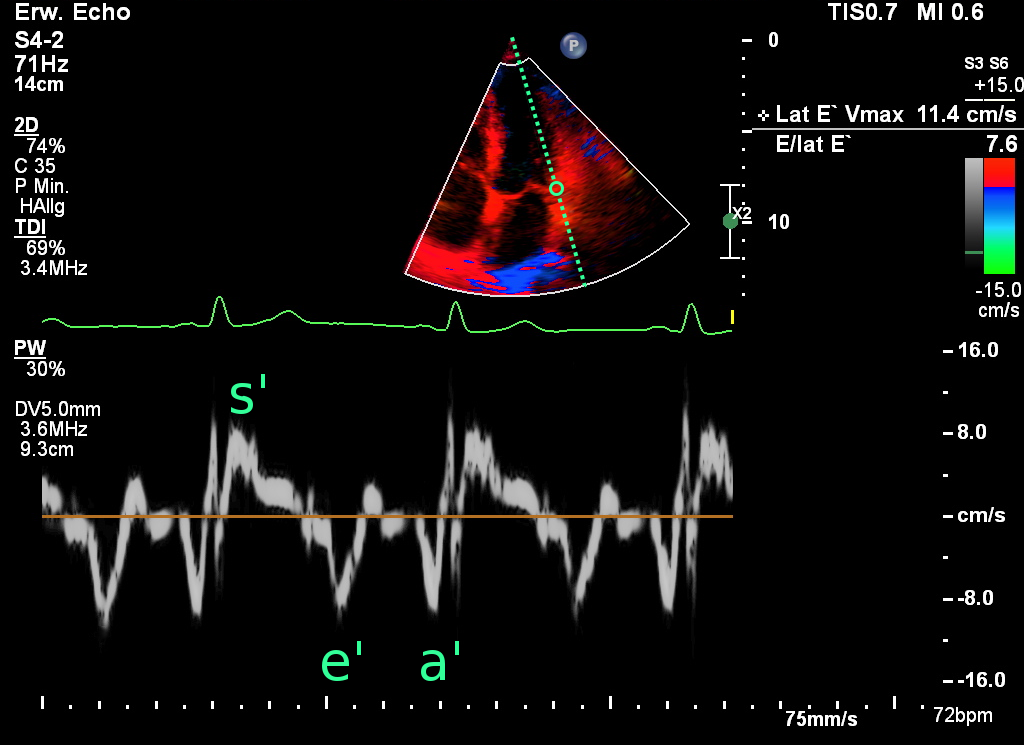 Abb.: Die im Gewebedoppler bestimmten Geschwindigkeiten am lateralen Mitralannulus
Abb.: Die im Gewebedoppler bestimmten Geschwindigkeiten am lateralen Mitralannulus
E/e'-Ratio
Die E/e'-Ratio ist neben e‘ der wesentliche Parameter zur Beurteilung der diastolischen Funktion und der
linksventrikulären Füllungsrücke.13 Für den Erhalt wird die maximale E-Wellen-Geschwindigkeit des
Einstroms über der Mitralklappe durch die maximale Geschwindigkeit des Mitralrings e‘ geteilt. Normalerweise liegt
das E/e'-Verhältnis bei <8. Bei diastolischer Dysfunktion bzw. gestörter Relaxation ist e' niedrig und es steigt
im Gegensatz die E-Welle bei erhöhtem Füllungsdruck an, so dass das E/e‘-Verhältnis abnimmt. Ein E/e'-Verhältnis von
>>14 ist bei Herzgesunden Personen ungewöhnlich und weist auf einen erhöhten Füllingsdruck hin. Anhand des
Verhältnisses kann der Fülldruck mit Hilfe der Nagueh-Formel abgeschätzt werden:14
Das E/e'-Verhältnis steigt mit dem Schweregrad der Herzinsuffizienz und korreliert mit dem NT pro BNP und nimmt ab,
wenn sich die Herzinsuffizienz bessert.15,16,17
Das vom medialen Mitralannulus abgeleitete E/e'-Verhältnis ist gewöhnlich höher als das vom lateralen. Ursache ist der
aufgrund der an die Ventilebene (Herzskelett) geringeren Fixierung lateral mobilere Mitralannulus der hierdurch eine
höhere e'-Geschwindigkeit aufweist. Die aus der lateralen und septalen E/e'-Ratio gebildete Mittelwert liefert den
höchsten Aussagewert.
Bei der Bewertung der E/e'-Ratio sollten weitere echokardiographische Parameter wie LV- und LA-Dimensionen sowie das
Alter und das Geschlecht berücksichtigt werden. Die E/e'-Ratio erhöht sich in Abhängigkeit vom Alter mit einer
statistisch signifikanten Korrelation insbesondere bei Personen über dem 60. Lebensjahr.18
Bei dekompensierter schwerer systolischer Herzinsuffizienz ist die E/e'-Ratio insbesondere bei großen
linksventrikulären Volumina, schlechtem Herzzeitvolumen und bei bestehender kardialer Resynchronisationstherapie nur
mit Vorsicht anzuwenden.19,20 Die Ratio kann durch eine begleitende
signifikante Mitralinsuffizienz (22% der Patienten) und ein vorhandenes Blockbild mit resultierender
Septumdyssynchronie (50% der Patienten) verfälscht sein.21
Darüber hinaus ist zu beachten, dass die E/e'-Ratio unter bestimmten klinischen Bedingungen keine Interpretation zulässt.
| Tachykardien mit E- und A-Wellen-Fusion | |
| unzuverlässige Bestimmung von E: | - bei Mitralinsuffizienz >II° |
| unzuverlässige Bestimmung von e‘: | - Mitralrekonstruktion- oder Klappenersatz |
| - schwere Mitralklappensklerose | |
| - signifikante Mitralstenose | |
| - Linksschenkelblock | |
| signifikanten Aortenklappeninsuffizienz |
Vorhofgrösse
Die Größe des linken Vorhofs korreliert mit der linksatrialen und der linksventrikulären Funktion. Sie ist ein
Marker sowohl der Ausprägung als auch der Dauer der der linksatrialen Druckerhöhung und damit der diastolischen
Beeinträchtigung. Die linke Vorhofgröße besitzt einen starken prognostischen Einfluss auf das Auftreten von
Herz-Kreislauf-Erkrankungen. 22,23
Da der linke Vorhof einen asymmetrischen Hohlraum darstellt, sollte dessen Größe über die Ermittlung des Volumens
bestimmt werden.24,25 Lineare Messungen können zu einer erheblichen
Unterschätzung führen.26,27So zeigte sich dann auch eine stärkere
Beziehung zwischen Herzkreislauferkrankungen und Vorhofvolumen als mit linearen Dimensionen.28
Es ist zu beachten, dass der linke Vorhof bei Ausdauersportlern mit hoher kardiorespiratorische Leistungsfähigkeit
dilatiert sein kann.29,30,31
In diesem Falle ist die Größe des linken Vorhofs bei dem Fehlen weiterer auf eine diastolische Dysfunktion hinweisende Parameter positiv mit einer höheren kardiorespiratorischen Fitness
assoziiert.32 Dies ist in der Beurteilung zu berücksichtigen. Die Assoziation zwischen kardiorespiratorischer Fitness und linksatrialer Vergrößerung ist im höheren Alter stärker ausgeprägt.
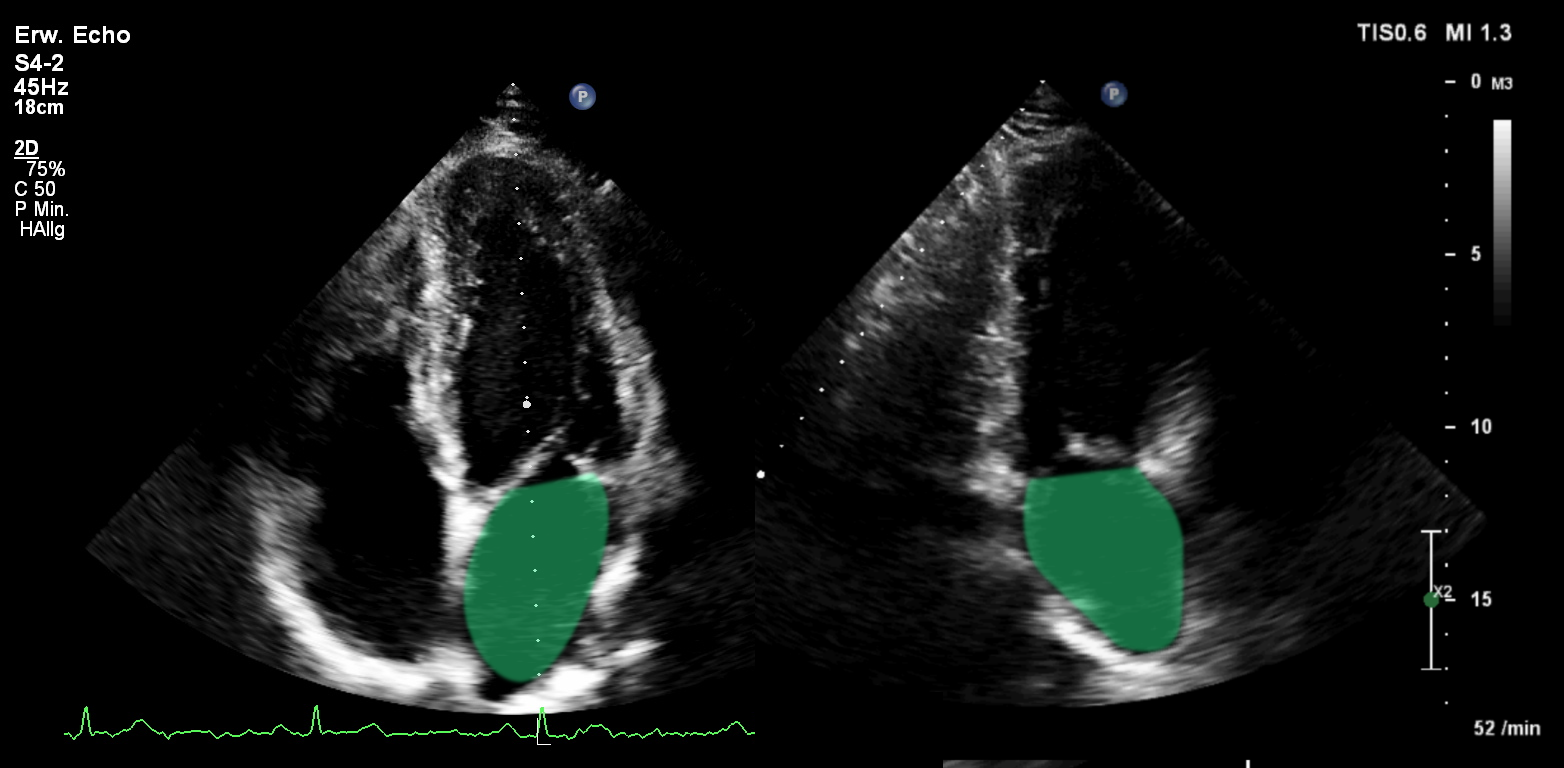 Abb.: Die Bestimmung des Vorhofvolumens mittels der Scheibchensummation nach
Simpson. In der Volumenberechnung werden die Einmündungen der Pulmonalvenen und das Vorhofsohr nicht berücksichtigt.
Abb.: Die Bestimmung des Vorhofvolumens mittels der Scheibchensummation nach
Simpson. In der Volumenberechnung werden die Einmündungen der Pulmonalvenen und das Vorhofsohr nicht berücksichtigt.
pulmonal-arterieller Druck
Ein erhöhter systolischer Druck in den Lungenarterien (PAPsystolisch) deutet in Abwesenheit einer pulmonalen
Gefäßerkrankung auf erhöhte linksventrikuläre Füllungsdrücke hin. Bei Patienten mit Linksherzerkrankung ist das
Vorliegen einer pulmonalen Hypertonie in der Regel ein Marker für eine fortgeschrittene Erkrankung, schwerere
Symptome und eine schlechtere Prognose.33,34,35
Die über dem Trikuspidalsegel gemessene maximale Geschwindigkeit eines Insuffizienzjet (TVRmax) erlaubt
über die simplifizierte Bernoulli-Gleichung eine zuverlässige Bestimmung des systolischen Druckgradienten.
Hier gilt ein Cut-off von >=280 cm/s bzw. >=36 mmHg für die Definition eines erhöhten Druckgradienten. Unter
Addition des echokardiographisch geschätzten rechtsatrialen Drucks (RAP) ließe sich der maximale pulmonale
Spitzendruck (PAPsyst) abschätzen. Zur Vermeidung von Fehlern, die durch die Abschätzung des RAP über die
Vena cava inferior-Weite verursacht werden, empfehlen die Leitlinien jedoch die Verwendung des TRVmax.
Zu beachten ist, dass die transoesophageale Echokardiographie zwar eine höhere Sensitivität (85%) aber nur eine
mäßige Spezifität (74%) für den Nachweis einer pulmonalen Hypertonie besitzt und möglicherweise nicht geeignet ist,
den pulmonal-arteriellen Druck bei Patienten mit Lungenerkrankungen sicher zu beurteilen (Sensitivität 81%,
Spezifität 61%).36 Bei schwerer Trikuspidalinsuffizienz wird das Dopplersignal zudem
aufgrund eines frühen Druckausgleichs zwischen RV und RA abgeschnitten, so dass der PAPsys durch die vereinfachte
Bernoulli-Gleichung unterschätzt wird. Als pathologisch gilt ein echokardiographisch ermittelter PAPsys von
>= 36 mmHg.37
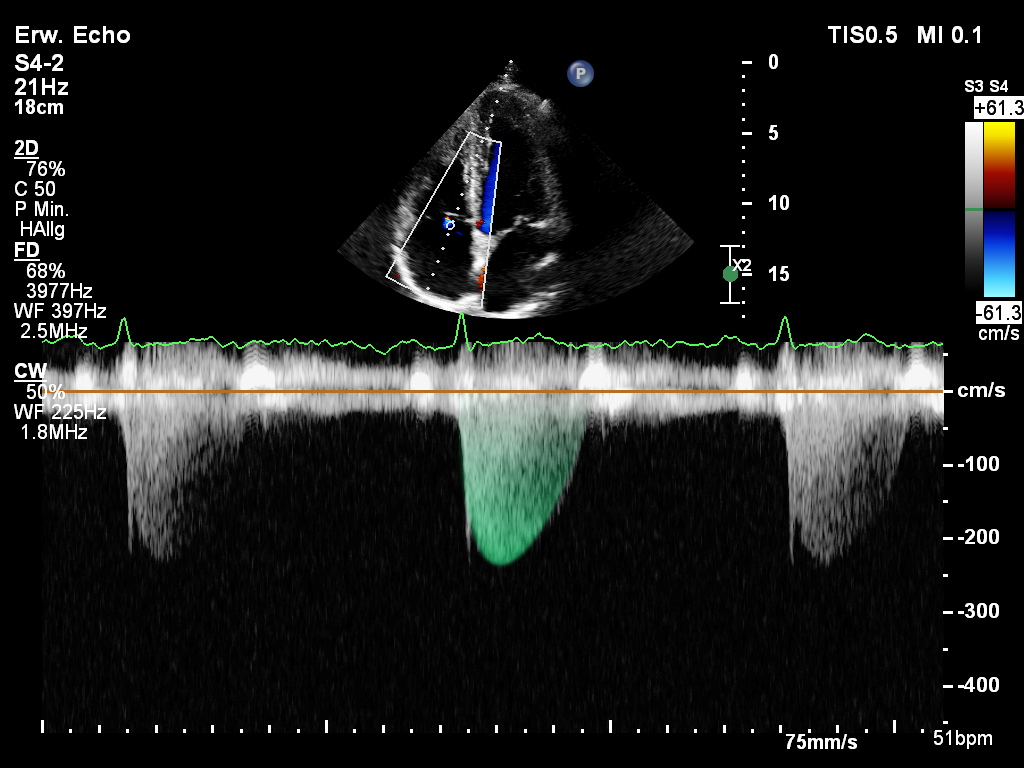 Abb.:Bestimmung des maximalen Druckgradienten über der Trikuspidalklappe mittels cw-Doppler
weiterlesen
Abb.:Bestimmung des maximalen Druckgradienten über der Trikuspidalklappe mittels cw-Doppler
weiterlesen
Literatur [verlinkt]
