echo-intensiv
Lungensonographie: abnorme Muster
Entstehungsmechanismus abnormer Muster
Unter bestimmten Umständen verändern sich die bei gesunder Lunge normalerweise vorhandenen im vorherigen Kapitel
genannten Reveberationsartefakte. Der Spiegeleffekt wird geringer, wenn der Luftgehalt der Lunge sinkt und der
Flüssigkeitsgehalt zunimmt. Wenn die Schallimpedanzen der Weichteile und Alveolen eng beieinander liegen, entsteht
ein reales Abbild der Lunge. Erkrankungen, die dazu führen, dass der Luftanteil zunimmt wie beispielsweise dem
akuten Asthma, der chronisch obstruktiven Lungenerkrankung oder dem Lungenemphysem führen hingegen zu keiner
Veränderung des Ultraschallbildes.1
Zwischen diesen beiden Ausprägungen gibt es fließende Übergänge. Das sich durch Verschiebung des Gleichgewichts
zwischen Luft und Flüssigkeiten ergebende sonographische Abbild der Lunge wird als alveolär-intersitielles Syndrom
bezeichnet. Die Zunahme des Flüssigkeitsgehalts führt zu einer Verdickung der interlobulären Septen und des
Lungeninterstitiums. Aufgrund des zu geringen räumlichen Auflösungsvermögens der Sonographie können die
subpleuralen Grenzflächen der Septen nicht als reale Strukturen dargestelllt werden.2 Durch
interne Nachhallphänomene, die ihren Ursprung in der Volumenänderungen des Verhältnisses zwischen den belüfteten
und den gewebeführenden Teilen der Lunge haben, entstehen vertikale Artefakte, die als B-lines bezeichnet
werden.3
Obwohl Luft die Rekonstruktion eines realen Abbildes der normalen Lunge einschränkt, reagiert die Sonographie sehr
empfindlich auf die krankheitsbedingte Veränderung der Organdichte.4,5
,6 Die Anwendung eines vereinfachtem Lungensonographie-Protokolls ist bei der Erstdiagnose
eines akuten respiratorischen Versagens während der ersten 2 Stunden genauer als die herkömmlichen diagnostischen
Instrumente und zeigt bessere unmittelbare Effekte auf die therapeutischen Entscheidung. Sie führt bei ca. 90% zur
sofortigen korrekten Diagnose.7
B-lines
Die Untersuchung auf B-lines stellt einen der interessantesten Aspekte der Lungensongraphie dar. Es sind echoreiche
aus aus multiplen sogenannten J-lines bestehende, atembewegliche Linien, die sich von der Pleuralinie aus sich bis
zum Bildschirmrand auffächern. Sie werden auch als Comet tail artefacts bezeichnet. Typischerweise löschen sie
A-lines aus.
Abb.: Darstellung von B-lines unter Verwendung eines Echokardiographie-Schallkopfes bei einem 75-jährigen
Patienten. Im Bild sind mehr als 2 B-lines erkennbar (= positver Scan) Die Schalltiefe könnte hier zur
Optimierung des B-Bildes auf 10 cm reduziert werden.
Zur Quali- bzw. Quantifizierung bzw. wird die Lunge in definierten Lungenabschnitten, den sogenannten
Volpicelli-Zonen untersucht. Als positiver Scan gilt das Auftreten von >=3 B-lines pro Zone. Sind 2 Zonen positiv
besteht ein sogenanntes alveolär-interstitielles Syndrom.1
Es besteht eine signifikante Beziehung der Anzahl von B-lines zur gravimetrischen Lungenwasserbestimmung, die
bereits vor erkennbarer Einschränkung der Oxygenierung auftritt.8 Dabei ist es der invasiven
Beurteilung eines interstitiellen Lungenödems mittels Rechtsherzkatheter oder PiCCO ebenbürtig.9
Die Sensitivität und Spezifizität lässt sich unter Kombination mit der transthorakalen Echokardiographie
(Sensitivität 97%, Spezifizität 95%) oder der NT-pro BNP-Bestimmung (>1,000 pg/mL, Sensitivität 100%,
Spezifizität 100%) weiter steigern und lässt sicher zwischen akutem Herzversagen und COPD/Asthma zu
differenzieren.9,10 Auch lässt sich der klinische Verlauf schnell
und einfach unter antikongestiven Therapie bei kardialer Dekompensation verfolgen.11,12,13
Sind lediglich A-lines und keine B-lines darzustellen schließt das bereits bis zu 95% und 100% eine Zunahme von
Lungenwasser aus.7,8,14,15.
Bei Vorhandensein von A-lines, B-lines, Lungengleiten und Lungenpuls (s.u.) ist ein Pneumothorax sicher
ausschließen.16,17,18,19
Da B-lines mit einer Verdickung der subpleuralen interlobularen Septen korrellieren, können sie neben einem pulmonalen interstitiellem
Ödem auch im Rahmen einer fibrotischen Verdickung bei pulmonaler Fibrose auftreten. Es sollte daher die Lungensonographie möglichst mit
einer Echokardiographie korreliert werden.
Es ist zu beachten, dass B-lines ihren Ursprung von der Pleura-Linie nehmen. Bei einem subkutanem Emphysem
(z.B. im Rahmen eines Pneumothorax bei Beatmungsschaden) können den B-lines ähnelnde Artefakte entstehen.
Diese als E-lines bezeichneten Artefakte löschen ebenfalls A-lines aus und fächern sich bis zum
Bildschirmrand auf. Sie nehmen ihren Ursprung jedoch oberhalb der Pleuralinie.
Interstitielles Syndrom
Beim interstitiellen Syndrom ist die Luft in den Alveolen aufgrund einer Flüssigkeitszunahme des Interstitiums
vermindert aber noch erhalten. Für ein interstitielles Syndrom kann ein kardiales Lungenödem, eine Pneumonie,
eine Pneumonitis, ein ARDS oder auch eine Lungenfinrose bedingt sein. Die Lungensonographie besitzt hier ein
hohes Potential für das Erkennen eines interstitiellen Syndroms (Spezifität 85.3%, Sensitivität
96.8%).2,20 Obwohl sie nicht sicher zwischen den unterschiedlichen
Ätiologien sicher differenzieren lässt, kann sie aber bettseitig unmittelbar in die Planung der weiterzuführenden
Diagnostik und die Therapie von dyspnoischen und kritisch Erkrankten eingreifen.
Bei der Beurteilung von Patienten mit akutem Lungenversagen ermöglicht ein positiver Scan (>=2 Volpicelli-Zonen
mit >=3 B-lines) die Unterscheidung zwischen einer kardiogenen und einer respiratorischen Ursache. Exazerbationen
einer chronisch obstruktiven Lungenerkrankung, einer Lungenembolie, einer lokalen Lungenentzündung und eines
Pneumothorax weisen keine B-lines auf.7,21,22,23
Die Lungensunographie weist eine hohe Übereinstimmung mit der radiologischen Diagnostik inklusive CT-Diagnostik
mit dem Vorteil des fehlenden Zeitverlustes.24
Abb.: Darstellung von multiplen B-lines (= positver Scan) unter Verwendung eines Abdomenschallkopfes bei einem 77-jährigen
Patienten mit akuter Linksherzdekompensation infolge eines akuten Vorderwandinfarktes.
Abb.: Lungensonographie einer Patientin, die sich aufgrund einer Abnahme ihres Allgemeinzustandes
in Verbindung mit einer Appetitlosigkeit, Gewichtsverlust und Übelkeit vorstellte. Es zeigen sich deutlich
abzeichnende B-lines (zur Verfügung gestellt von H. Findeisen).
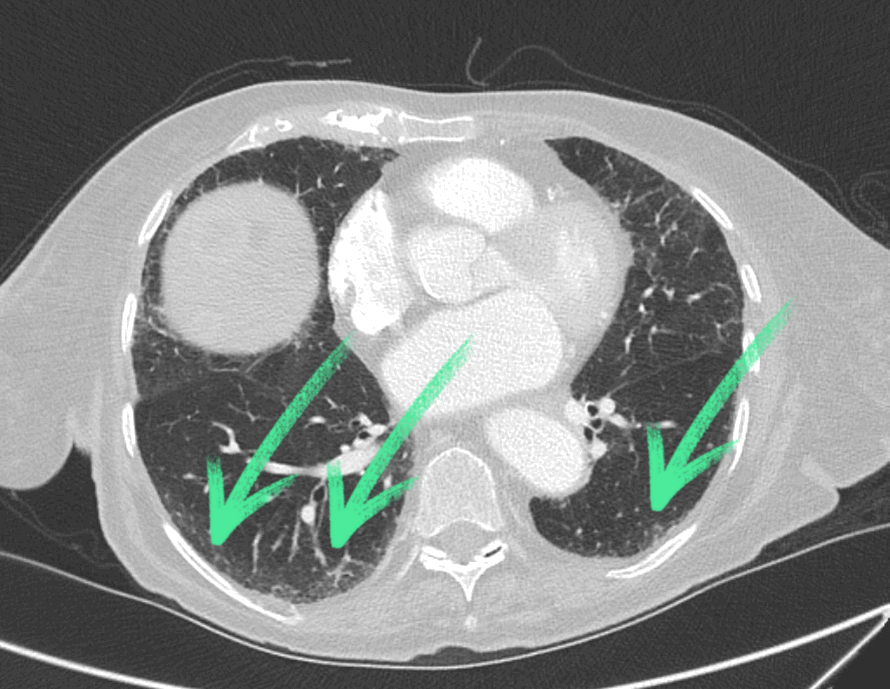 Abb.: In dem dazugehörigen CT-Thorax zeigt sich in der Lunge beidseits eine
leichtgradige subpleurale Fibrose (pulmonale Komplikation einer rheumatoiden Arthritis), die ursächlich
für die gesehenen B-Lines ist. Es stellen sich keine infiltrativen Veränderungen dar. Die rundliche Formation
im Bereich der rechten Lunge endspricht dem Anschnitt des Zwerchfells. Nebenbefundlich Aneurysma der Aorta
ascendens (5,2 cm Weite).
Abb.: In dem dazugehörigen CT-Thorax zeigt sich in der Lunge beidseits eine
leichtgradige subpleurale Fibrose (pulmonale Komplikation einer rheumatoiden Arthritis), die ursächlich
für die gesehenen B-Lines ist. Es stellen sich keine infiltrativen Veränderungen dar. Die rundliche Formation
im Bereich der rechten Lunge endspricht dem Anschnitt des Zwerchfells. Nebenbefundlich Aneurysma der Aorta
ascendens (5,2 cm Weite).
Bei sehr ausgeprägtem Befund eines interstitiellen Syndroms kann es zur Konfluktation der B-Lines kommen. In
dieser Maximalausprägung zeigt sich dann eine homogene hyperechogene Lunge, welches als White lung bezeichnet
wird. Auffälliges Merkmal ist hierbei das Fehlen von A-lines
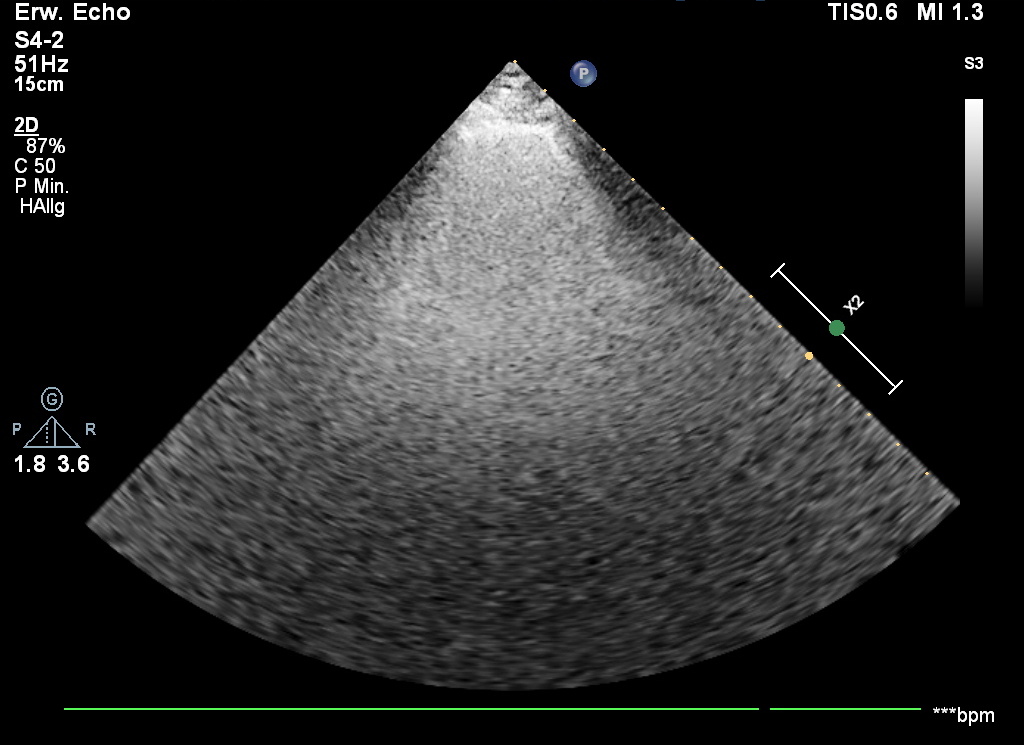 Abb.: Lungensonographie einer Patientin, die sich aufgrund einer in der bisherig nicht erklärbaren langsam
progredienten Dyspnoe vorstellte. Die bisherige ambulante und auch stationäre(!) Abklärung hatte bislang
keine Diagnose liefern können. In des im Rahmen der echokardiographischen Untersuchung durchgeführten Screening
der Lunge zeigte sich dann in allen Volpicelli-Zonen eine auffällige gleichermaßen hyperechogene Darstellung
der Lunge (White lung). Die Pleuralinie bildet sich zudem verdickt ab. A-lines sind nicht mehr erkennbar.
Die hierauf veranlasste gezielte radiologische Diagnostik stellte rasch die Diagnose einer UIP.
Abb.: Lungensonographie einer Patientin, die sich aufgrund einer in der bisherig nicht erklärbaren langsam
progredienten Dyspnoe vorstellte. Die bisherige ambulante und auch stationäre(!) Abklärung hatte bislang
keine Diagnose liefern können. In des im Rahmen der echokardiographischen Untersuchung durchgeführten Screening
der Lunge zeigte sich dann in allen Volpicelli-Zonen eine auffällige gleichermaßen hyperechogene Darstellung
der Lunge (White lung). Die Pleuralinie bildet sich zudem verdickt ab. A-lines sind nicht mehr erkennbar.
Die hierauf veranlasste gezielte radiologische Diagnostik stellte rasch die Diagnose einer UIP.
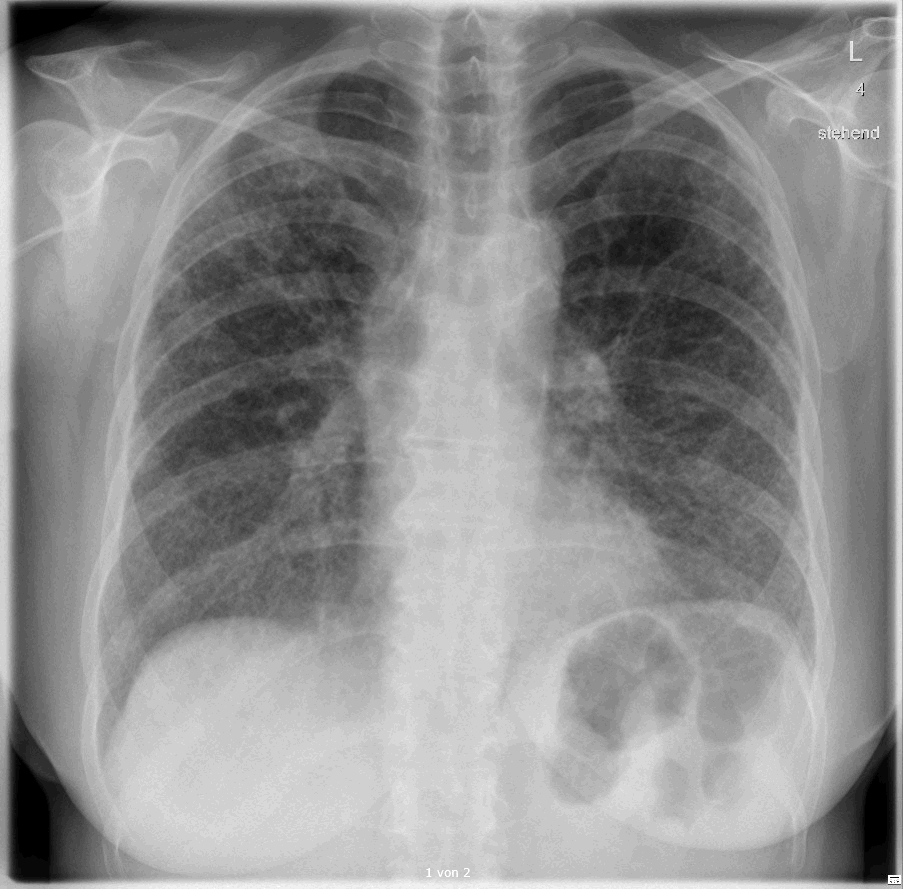 Abb.: In der dazugehörigen Röntgen-Übersichtsaufnahme des Thorax zeigte sich eine unklarer alveoläre
und interstitieller Lungenprozess.
Abb.: In der dazugehörigen Röntgen-Übersichtsaufnahme des Thorax zeigte sich eine unklarer alveoläre
und interstitieller Lungenprozess.
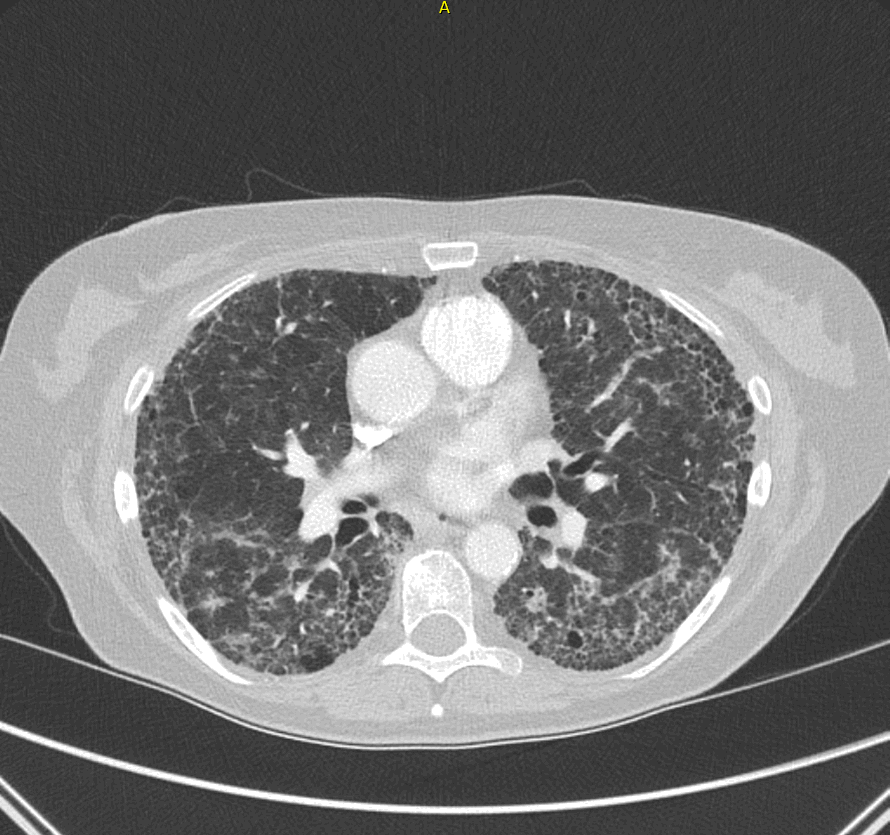 Abb.: In dem dazugehörigen CT-Thorax zeigt sich ein ausgeprägter interstitieller Lungenprozess mit
Honigwabenumbau und Bronchiektasen.
Abb.: In dem dazugehörigen CT-Thorax zeigt sich ein ausgeprägter interstitieller Lungenprozess mit
Honigwabenumbau und Bronchiektasen.
Bei Beatmungspatienten mit ARDS ermöglicht die sonographische Beurteilung der Lunge die Überwachung der Erholung
und kann zur Führung von therapeutischen Manövern verwendet werden.25
Alveolares Syndrom
Ein massiver Verlust an Luft (z.B. Atelektasen) und Zunahme an Flüssigkeit führen zu einer Konsolidierung der
Lunge. Dies wird als alveoläres Sndorm bezeichnet. Wenn die Konsolidierung die Pleura erreicht und sich keine
belüftete Lunge unter der Sonde befindet, stellt sich die Lunge sonographisch mit einer gewebeähnliche Textur
dar.26,27,28,29,30
Bei vollständigem Verlust der Luft entsteht ein Bild, das jenem Computertomographie oder der Magnetresonanz
nahe kommt.1 Vorteil der Sonographie ist, dass eine Analyse der Atembewegungen in Echtzeit
möglich ist.
Abb. Beatmete Patientin im ARDS. Die Lunge ist vollständig konsolidiert (alveolares Syndrom) und weist eine der
Leber ähnliche Gewebstextur auf. Das Bronchialsystem lässt sich abgrenzen. In diesem sind noch Lufteinschlüsse
erkennbar. Desweiteren besteht ein Pleuraerguss.
Die Beurteilung der Struktur, des Rands, der Verteilung, der Vaskularisierung und spezieller Charakteristika
wie Luft- und Flüssigkeitsbronchogramme können eine Differenzierung unterschiedlicher Erkrankungen zulassen
(z.B. Lungenentzündung, Lungeninfarkte bei Lungenembolie, Lungenkontusion, Obstruktions- und
Kompressionsatelektasen).27,31,32,33,34
Die unkomplizierten und rasche Durchführbarkeit der Lungensonographie ermöglicht bei Bedarf die tägliche
Kontrolle bei kritisch kranken Patienten und damit die Überwachung der Wirkung von Antibiotika und der Beatmung
bei Beatmungspatienten.25,29,35
In der Restitution der Lungenfunktion kann hier sonographisch die Veränderung vom alveolaren Muster der
konsolidierten Lunge über das interstitielle Muster, das sich mit abnehmender Dichte und Anzahl der B-Linien
verbessert, bis hin zum Muster der normalen Belüftung mit A-lines nachvollzogen werden.36
Häufig treten jedoch alveolare und interstitielle Muster bei schweren Erkrankungen nebeneinander in der Lunge auf.
Dies wird durch Areale unterschiedlicher Belüftungsgrade hervorgerufen. Es empfähle sich daher im
lungensonographischen Befund die Lokalisation ggf. mit Bilddokumentation festzuhalten.
Abb. Beatmete Patientin im ARDS. Sonographisch zeigt sich gut abgrenzbar das Nebeneinander von B-lines und einer
alveolären Konsolidierung der Lunge mit Lufteinschlüssen. Im Bereich der B-lines (interstitielles Syndrom) findet
noch ein Gasaustauch statt. Die B-Lines konfluieren, so dass die Lunge in diesem Bereich weiss erscheint. Dies wird
auch als weisse Lunge bezeichnet (White lung-sign). Der Übergang der noch ventilierten zur konsolidierten Lunge mit
den Lufteinschlüssen wird als Shred-sign bezeichnet.
weiterlesen
Literatur [verlinkt]
